腫瘍細胞
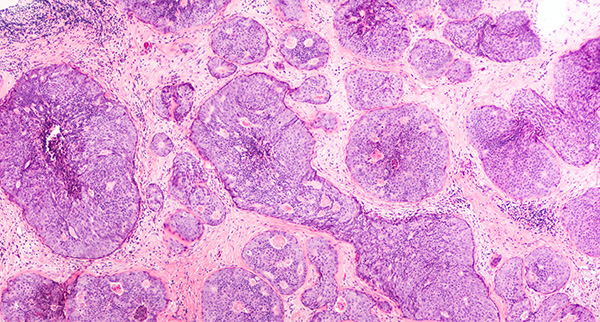
腫瘍細胞は無秩序に増殖し、悪性、前がん性、良性の組織塊を形成します。悪性細胞は、アポトーシスを通じて細胞分裂のバランスを維持するシグナルを回避することにより、高速で制御不能な腫瘍増殖を可能にしています1。これらの悪性細胞は、単一の回遊循環腫瘍細胞(CTC)またはCTCクラスタとして全身を移動し、転移や二次腫瘍発生の前駆体となります2。
形成と構造
腫瘍細胞は、細胞増殖を制御する様々な遺伝子ネットワークにおける突然変異の蓄積から生じます。がん抑制遺伝子の調節不全やがん遺伝子の活性化など、がん関連遺伝子の発現の変化が、制御不能な細胞分裂を引き起こします3。エピジェネティックなヒストン修飾の異常やクロマチン再構成機構の破壊も、腫瘍細胞形成において重要な役割を果たすことが示されています4。こうした異常が重なることで、細胞は正常な機能を徐々に喪失し、転移、血管新生、アポトーシス回避などの悪性特性が強まり、最終的に腫瘍形成に至ります。
正常組織細胞とがん細胞の間には、形態学的および機能的な違いが多くあり、臨床の現場ではそうした違いを利用して、腫瘍が悪性かを判断します。がん細胞は大きさや形が不規則で、細胞間のばらつきが正常細胞よりも大きくなります。また核が異常に大きく、核小体が明瞭で、細胞質が乏しいのが特徴です5。
機能
アポトーシスの回避
がん細胞は、アポトーシス経路を調節して細胞死を回避し、生き残ることができます。腫瘍細胞は、抗アポトーシス遺伝子の発現を増加させ、プロアポトーシス遺伝子の発現を減少させることによってアポトーシスを回避します。また、抗アポトーシスやプロアポトーシスタンパク質の安定性を変化させたり、翻訳後修飾によって機能を調整したりすることで、アポトーシスを回避することもできます6。
免疫の回避
腫瘍細胞の生存は免疫系からの回避に大きく依存しており、その手段として、免疫認識の回避や免疫抑制性腫瘍微小環境(TME)の維持を行います7 。腫瘍細胞は、細胞表面抗原の発現を失い、抗原提示能が低下することで、細胞傷害性T細胞による認識を回避し、エフェクター分子に対する耐性を獲得します8。また、免疫抑制性分子の分泌や、阻害性チェックポイント分子の発現、ケモカインや制御性T細胞(Treg)の動員によって、免疫耐性TMEを形成することもあります。 動員されたTreg細胞は、ヘルパーT細胞(Th1)やナチュラルキラー細胞などの細胞傷害性エフェクター免疫細胞の活性化を抑制して、免疫応答を回避する役割を担っています9。免疫チェックポイントリガンド(PDL1/L2、CD47、CD155(PVR)、CD112、CEACAM-1)はT細胞受容体に結合して抗腫瘍反応を抑制し、腫瘍細胞が免疫サーベイランスから逃れられるようにしています10。
血管新生
腫瘍細胞は、血管新生を介して既存の血管から新たな血管を形成して、増殖に不可欠な栄養と酸素を確保するとともに、血流へ移行するための経路も獲得します。血管の恒常性は、通常、血管新生促進因子と抗血管新生因子のバランスによって維持されています。腫瘍内で血管新生促進シグナルが上昇すると、血管形成を誘発し、内皮細胞も活性化されます。その結果、悪性細胞の休眠が解除され、腫瘍増殖が促進されます11。
転移
転移は悪性腫瘍の特徴であり、原発腫瘍から他の組織や臓器へ細胞が広がることで発生します。固形がんでは患者死亡の90%が転移によるものです12。転移のプロセスは、腫瘍細胞が細胞外マトリクスを破って周囲組織へ浸潤し、これが血管新生と結びつくことで始まります。血管内侵入により、CTCは全身を移動し他の組織に到達することができるようになり、そこで増殖して二次腫瘍を形成するか、休眠状態に入ります13,14。また、CTCは好中球を伴ったクラスタで移動し、細胞周期の進行を助け、より悪性度の高い転移形成につながることが研究によって示されています15。
近年注目されている研究
研究によって、がんを検出、除去、腫瘍発生予防、そして最終的にはがん治療成績の改善につながる信頼性の高い新たなアプローチが次々と明らかになっています。CAR-T16、CAR-NK17、CAR-M18療法など、個別化医療の分野は大きく進歩しています。これらはいずれも、体内の免疫細胞を再プログラムして腫瘍細胞を攻撃させる治療法です19。
腫瘍細胞を研究するためのツール
細胞表面マーカーとフローサイトメトリーを用いた細胞周期解析を組み合わせることによって、正常な細胞と腫瘍細胞を識別することができます。これは、腫瘍増殖の基盤となるメカニズムの解明や治療法の検討に有用です20,21。
転移の重要な指標であるCTCは、液体生検から捕捉・濃縮でき、その後、免疫蛍光法やPCRベースの手法を用いて他の細胞と識別することが可能です22。セルソーティング技術は、蛍光標識を柔軟に添加して、分子レベルの詳細解析に適した単一細胞の分取が可能で、様々なCTC研究を支えます23。サンプルの消費を最小限に抑えながら、CTCを濃縮して検出するための新しいマイクロ流体デバイスも開発されています24。高分解能の時空間的イメージングにより、転移過程のCTCの動態をリアルタイムで追跡し、細胞間の相互作用を可視化します。 また、 TME全体および腫瘍と免疫細胞間の相互作用を研究するための、腫瘍、スフェロイド、オルガノイドの3D in vitroモデルも開発されています26。
細胞マーカー
腫瘍細胞の検出に使用される細胞マーカーは、細胞株やがん種によって異なります。また多くの場合、他の共発現メーカーの異常な発現パターンと組み合わせて識別します。CTCの最も一般的な細胞マーカーは、汎上皮細胞マーカーEpCAMおよびサイトケラチンです27,28。さらに、腫瘍細胞の転移特性は、上皮間葉転移(EMT)のマーカーであるビメンチンを用いて調べることが可能で、その過剰発現は腫瘍の増殖や転移と相関しています29。
関連製品
参考文献
1. Fulda S, Debatin KM. Apoptosis signaling in tumor therapy. (2004) Annals of the New York Academy of Science. 1028:150-6. doi: 10.1196/annals.1322.016. PMID: 15650241.
2. Rushton AJ, Nteliopoulos G, Shaw JA, Coombes RC. A Review of Circulating Tumour Cell Enrichment Technologies. Cancers (Basel). 2021 Feb 26;13(5):970. doi: 10.3390/cancers13050970. PMID: 33652649; PMCID: PMC7956528.
3. Curtius, K., Wright, N. A., & Graham, T. A. (2017). Evolution of Premalignant Disease. Cold Spring Harbor perspectives in medicine, 7(12), a026542. https://doi.org/10.1101/cshperspect.a026542
4. Muntean, A. G., & Hess, J. L. (2009). Epigenetic dysregulation in cancer. The American journal of pathology, 175(4), 1353–1361. https://doi.org/10.2353/ajpath.2009.081142
5. Baba AI, Câtoi C. Comparative Oncology. Bucharest (RO): The Publishing House of the Romanian Academy; 2007. Chapter 3, TUMOR CELL MORPHOLOGY. Available from: https://www.ncbi.nlm.nih.gov/books/NBK9553/
6. Sharma, A., Boise, L. H., & Shanmugam, M. (2019). Cancer Metabolism and the Evasion of Apoptotic Cell Death. Cancers, 11(8), 1144. https://doi.org/10.3390/cancers11081144
7. Gonzalez, H., Hagerling, C., & Werb, Z. (2018). Roles of the immune system in cancer: from tumor initiation to metastatic progression. Genes & development, 32(19-20), 1267–1284. https://doi.org/10.1101/gad.314617.118
7. Gonzalez, H., Hagerling, C., & Werb, Z. (2018). Roles of the immune system in cancer: from tumor initiation to metastatic progression. Genes & development, 32(19-20), 1267–1284. https://doi.org/10.1101/gad.314617.118
7. Gonzalez, H., Hagerling, C., & Werb, Z. (2018). Roles of the immune system in cancer: from tumor initiation to metastatic progression. Genes & development, 32(19-20), 1267–1284. https://doi.org/10.1101/gad.314617.118
8. de Charette M, Marabelle A, Houot R. (2016) Turning tumour cells into antigen presenting cells: The next step to improve cancer immunotherapy? European Journal of Cancer. 68:134-147. DOI: 10.1016/j.ejca.2016.09.010. PMID: 27755997.
9. Ward‐Hartstonge, K. A., & Kemp, R. A. (2017). Regulatory T‐cell heterogeneity and the cancer immune response. Clinical & translational immunology, 6(9), e154.
10. Hu, M., Li, Y., Lu, Y., Wang, M., Li, Y., Wang, C., Li, Q., & Zhao, H. (2021). The regulation of immune checkpoints by the hypoxic tumor microenvironment. PeerJ, 9, e11306. https://doi.org/10.7717/peerj.11306
11. Lugano, R., Ramachandran, M. & Dimberg, A. Tumor angiogenesis: causes, consequences, challenges and opportunities. Cell. Mol. Life Sci. 77, 1745–1770 (2020). https://doi.org/10.1007/s00018-019-03351-7
12. Jiang WG, Sanders AJ, et al. Tissue invasion and metastasis: Molecular, biological and clinical perspectives. Semin Cancer Biol. 2015 Dec;35 Suppl:S244-S275. doi: 10.1016/j.semcancer.2015.03.008. Epub 2015 Apr 10. PMID: 25865774.
13. Micalizzi, D. S., Maheswaran, S., & Haber, D. A. (2017). A conduit to metastasis: circulating tumor cell biology. Genes & development, 31(18), 1827–1840. https://doi.org/10.1101/gad.305805.117
14. Bielenberg, D. R., & Zetter, B. R. (2015). The Contribution of Angiogenesis to the Process of Metastasis. Cancer journal (Sudbury, Mass.), 21(4), 267–273. https://doi.org/10.1097/PPO.0000000000000138
15. Szczerba BM, Castro-Giner F, Vetter M, Krol I, Gkountela S, Landin J, Scheidmann MC, Donato C, Scherrer R, Singer J, Beisel C, Kurzeder C, Heinzelmann-Schwarz V, Rochlitz C, Weber WP, Beerenwinkel N, Aceto N. Neutrophils escort circulating tumour cells to enable cell cycle progression. Nature. 2019 Feb;566(7745):553-557. doi: 10.1038/s41586-019-0915-y. Epub 2019 Feb 6. PMID: 30728496.
16. Mehrabadi, A. Z., Ranjbar, R., Farzanehpour, M., Shahriary, A., Dorostkar, R., Hamidinejad, M. A., & Ghaleh, H. E. G. (2022). Therapeutic potential of CAR T cell in malignancies: A scoping review. Biomedicine & Pharmacotherapy, 146, 112512.
17. Wang, W., Jiang, J., & Wu, C. (2020). CAR-NK for tumor immunotherapy: Clinical transformation and future prospects. Cancer letters, 472, 175-180.
18. Moradinasab S, Pourbagheri-Sigaroodi A, Ghaffari SH, Bashash D. Targeting macrophage-mediated tumor cell phagocytosis: An overview of phagocytosis checkpoints blockade, nanomedicine intervention, and engineered CAR-macrophage therapy. International Immunopharmacology. 2021 Dec;103:108499. DOI: 10.1016/j.intimp.2021.108499. PMID: 34972068.
19. Ahn, J. C., Teng, P. C., Chen, P. J., Posadas, E., Tseng, H. R., Lu, S. C., & Yang, J. D. (2021). Detection of Circulating Tumor Cells and Their Implications as a Biomarker for Diagnosis, Prognostication, and Therapeutic Monitoring in Hepatocellular Carcinoma. Hepatology, 73(1), 422-436.
20. Kim, K. H., & Sederstrom, J. M. (2015). Assaying Cell Cycle Status Using Flow Cytometry. Current protocols in molecular biology, 111, 28.6.1–28.6.11. https://doi.org/10.1002/0471142727.mb2806s111
21. Cobb, L., & Das, S. (2013). The Cell cycle analysis. MATER METHODS. 3:172. Accessed: https://www.labome.com/method/The-Cell-Cycle-Analysis.html
22. Lopresti, A., Malergue, F., Bertucci, F., Liberatoscioli, M. L., Garnier, S., DaCosta, Q., Finetti, P., Gilabert, M., Raoul, J. L., Birnbaum, D., Acquaviva, C., & Mamessier, E. (2019). Sensitive and easy screening for circulating tumor cells by flow cytometry. JCI insight, 5(14), e128180.
23. Lopresti A, Malergue F, Bertucci F, Liberatoscioli ML, Garnier S, DaCosta Q, Finetti P, Gilabert M, Raoul JL, Birnbaum D, Acquaviva C, Mamessier E. Sensitive and easy screening for circulating tumor cells by flow cytometry. JCI Insight. 2019 Jun 13;5(14):e128180. doi: 10.1172/jci.insight.128180. PMID: 31194699; PMCID: PMC6675556.
24. Hu, X., Zang, X., & Lv, Y. (2021). Detection of circulating tumor cells: Advances and critical concerns. Oncology letters, 21(5), 422. https://doi.org/10.3892/ol.2021.12683
25. Su, S., & Li, X. (2021). Dive into Single, Seek Out Multiple: Probing Cancer Metastases via Single-Cell Sequencing and Imaging Techniques. Cancers, 13(5), 1067. https://doi.org/10.3390/cancers13051067
26. Shelton, S. E., Nguyen, H. T., Barbie, D. A., & Kamm, R. D. (2020). Engineering approaches for studying immune-tumor cell interactions and immunotherapy. iScience, 24(1), 101985. https://doi.org/10.1016/j.isci.2020.101985
27. Welinder C, Jansson B, Lindell G, Wenner J. Cytokeratin 20 improves the detection of circulating tumor cells in patients with colorectal cancer. Cancer Lett. 2015 Mar 1;358(1):43-6. doi: 10.1016/j.canlet.2014.12.024. Epub 2014 Dec 17. PMID: 25528628.
28. Ulrich H, Tárnok A. Flow cytometry detection of circulating tumor cells: achievements and limitations as prognostic parameters. Cytometry A. 2014 Mar;85(3):201-2. doi: 10.1002/cyto.a.22441. PMID: 24535954.
29. Mittal V. Epithelial Mesenchymal Transition in Tumor Metastasis. Annu Rev Pathol. 2018 Jan 24;13:395-412. doi: 10.1146/annurev-pathol-020117-043854. PMID: 29414248.

