内皮細胞
内皮細胞(ECs)は、動脈、毛細血管、静脈を含むすべての血管の内壁を覆う、一層の内皮を形成します。この内皮層は血管内腔と周囲組織を隔てるバリアとして働き、その間を行き来する流体や栄養分の通過を調節します1。
形成と構造
内皮細胞の形状と大きさはその血管種特異性により異なりますが、一般的には、薄くて長さが約30-50 µmの細長い形状です2。ECsは、中胚葉由来の血管芽細胞や血管血液芽細胞から、胚発生期にも成体期にも発生すると考えられています3。
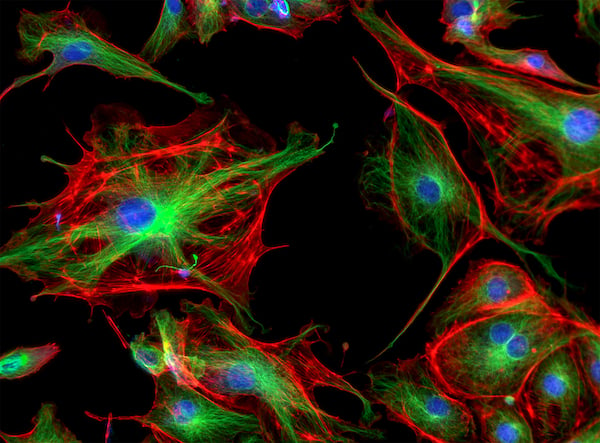
原始内皮細胞は、動脈性、静脈生、造血性、リンパ性の組織特異的なフェノタイプに分化し、血管発生においてそれぞれ異なる役割を果たします。FOXおよびETS転写因子ファミリーは、内皮細胞の特性の決定と確立に重要であることが示されています。 また、内皮細胞の生存・増殖・分化・血管透過性を調節する血管新生因子である血管内皮成長因子(VEGF)は、多くの腫瘍で高発現するため、がん治療の重要な標的となることが示されています5。
機能
内皮細胞は、体内のすべての血管内において、血液と周の組織との間に半透過性のバリアを形成します。この単層の内皮は重要な内分泌器官であり、血液流動性、溶質や高分子の移動、免疫応答、炎症の調節に大きな役割を果たしていることが示されています6。
血管透過性
内皮細胞はその性質と機能に応じて、連続内皮または多孔質内皮を形成します。これにより、血管内腔と周囲組織との間での流体や栄養分の通過量を調節できます。
血流
内皮細胞は、様々な血管作動因子を放出することで、内皮直下の平滑筋を弛緩・収縮させ、血流を調節します。血管拡張因子は一酸化窒素(NO)、プロスタサイクリ(PGl2)、内皮由来過分極因子(EDHF)等で、血管収縮因子はトロンボキサン(TXA2)、ノルエピネフリン、エンドセリン-1 (ET-1)等です7。炎症反応時に内皮細胞が血流を増加させることは、白血球の組織送達を促進するだけでなく、血漿タンパク質の漏出を増やし、好中球の活性化を促すためのECsの重要な機能です8。
止血と血栓症
内皮細胞は止血(出血の停止)の維持や、血栓症の予防に不可欠です。正常に機能する内皮は、抗血小板・抗凝固因子を放出し、血小板凝集やフィブリン形成を防ぎます。内皮はプロスタサイクリンを介して抗血栓性の表面を形成し、血小板凝集を抑えることによって血漿や細胞成分が血管内を円滑に流れるようにしています9。血管が損傷すると、ECsは血小板の接着や第VIII因子による血液凝固、血小板凝集やフィブリン形成を促進します10。創傷治癒の過程で、ECsは線溶促進因子を放出し、血栓の分解を促す線溶反応を活性化します。
健康および疾患における役割
血管新生は厳密に制御された発生プログラムに依存しており、異常な増殖は内皮機能不全を引き起こす可能性があります。異常な内皮細胞や血管構造は、がん、アテローム性動脈硬化症、その他の心臓疾患、網膜症、脳卒中、慢性腎不全をはじめとする様々な疾患に共通する特徴です。内皮細胞の不均一性を評価することは、健康状態の指標として有用です。内皮機能の評価は、心血管疾患患者における将来の心臓イベントの予測に役立ちます7また 血管新生における内皮細胞の役割は、腫瘍形成を研究する研究者にとって特に関心の深いテーマです。
近年注目されている研究
現在の研究では、COVID-19を含むウイルス感染11、肝疾患12、肺動脈高血圧13などの様々な病態における内皮細胞の役割に重点が置かれています。 内皮細胞マーカーの発現の変化は、内臓肥満やインスリン抵抗性に関連しています14。また、ECsは増殖を促進する微小環境を調節することによって腫瘍増殖を後押しすることも示されており15、この知見は新たな腫瘍の治療標的の可能性を開きます16。
内皮細胞を研究するためのツール
内皮細胞マーカーは、フローサイトメトリーや免疫細胞染色などの免疫染色法で同定できます。酵素結合免疫吸着アッセイ(ELISA)では、VEGFなどの関連する可溶性化合物を定量できます17。蛍光標識ブロモデオキシウリジン(BRdU)取り込みやCSFE色素希釈はフローサイトメトリーを用いる手法で、ECsのシングルセル解析が可能です。内皮細胞培養モデルを用いて、正常血管および病的血管の生理的圧力、伸張、せん断応力を模倣できます18。遺伝子導入も、内皮細胞の個々の遺伝子やタンパク質の機能を解析する有用なツールとして、注目されています19。
細胞マーカー
内皮細胞が発現するマーカーは、発生段階と組織特異的分化によって異なります。CD31(PECAM-1)は、内皮細胞上で恒常的に発現しています。CD34は内皮前駆細胞上で発現しますが、多くの場合、成熟の過程で失われます20,21。CD54およびTekは血管内皮細胞に、LYVE-1はリンパ管内皮細胞の表面に発現しています。内皮細胞が産生・調節する因子(血管新生に用いられる受容体チロシンキナーゼ VEGFR222や、止血に 関与する糖タンパク質von Willebrand factor(VWF)など)は細胞マーカーとしても有用です23。
各ECマーカーの概要
| 細胞マーカー | 別称 | 発現部位 |
|---|---|---|
| CD13 | TAPN | 細胞表面 |
| CD29 | インテグリン β1 | 細胞表面 |
| CD31 | PECAM-1 | 細胞表面 |
| CD34 | 内皮前駆細胞の細胞表面 | |
| CD39 | NTPDase 1, TPDase | 細胞表面 |
| CD44 | 細胞表面 | |
| CD49a | インテグリンα1、VLA-1, ITGA1 | 細胞表面 |
| CD54 | ICAM-1, BB2 | 細胞表面 |
| CD73 | 5'-ヌクレオチダーゼ、NT5E, E5NT | 細胞表面 |
| CD93 | C1qR, C1QR1, MXRA4 | 細胞表面 |
| CD105 | エンドグリン、ENG, END, ORW | 細胞表面 |
| CD141 | BDCA-3, TM | 細胞表面 |
| CD143 | ACE | 細胞表面 |
| CD144 | カドヘリン5, VE -カドヘリン | 細胞表面 |
| CD157 | BST-1 | 細胞表面 |
| CD201 | EPCR | 細胞表面 |
| CD309 | VEGFR2, KDR, Flk-1 | 細胞表面 |
| Tek | Tie-2 | 細胞表面 |
| LYVE-1 | 細胞表面 | |
| VWF | 細胞表面 |
参考文献
1. Aman, J., Weijers, E. M., van Nieuw Amerongen, G. P., Malik, A. B., & van Hinsbergh, V. W. (2016). Using cultured endothelial cells to study endothelial barrier dysfunction: Challenges and opportunities. American journal of physiology. Lung cellular and molecular physiology, 311(2), L453–L466. https://journals.physiology.org
2. Krüger-Genge, A., Blocki, A., Franke, R. P., & Jung, F. (2019). Vascular Endothelial Cell Biology: An Update. International journal of molecular sciences, 20(18), 4411. https://www.mdpi.com
3. Tsuji-Tamura, K., Ogawa, M. Morphology regulation in vascular endothelial cells. Inflammation and Regeneration. 38, 25 (2018). https://inflammregen.biomedcentral.com
4. De Val, S., Chi, N. C., et al. (2008). Combinatorial regulation of endothelial gene expression by ets and forkhead transcription factors. Cell, 135(6), 1053–1064. https://www.cell.com
5. Duffy AM, Bouchier-Hayes DJ, Harmey JH. Vascular Endothelial Growth Factor (VEGF) and Its Role in Non-Endothelial Cells: Autocrine Signalling by VEGF. In: Madame Curie Bioscience Database [Internet]. Austin (TX): Landes Bioscience; 2000-2013. Available from: https://www.ncbi.nlm.nih.gov
6. Félétou M. (2011) The Endothelium: Part 1: Multiple Functions of the Endothelial Cells—Focus on Endothelium-Derived Vasoactive Mediators. San Rafael (CA): Morgan & Claypool Life Sciences. Available from: https://www.ncbi.nlm.nih.gov
7. Sandoo, A., van Zanten, J. J., et al. (2010). The endothelium and its role in regulating vascular tone. The open cardiovascular medicine journal, 4, 302–312. https://opencardiovascularmedicinejournal.com
8. Pober, J., Sessa, W. (2007). Evolving functions of endothelial cells in inflammation. Nat Rev Immunol 7, 803–815. https://www.nature.com
9. Rajendran, P., Rengarajan, T., et al. (2013). The vascular endothelium and human diseases. International journal of biological sciences, 9(10), 1057–1069. https://www.ijbs.com
10. Neubauer, K., Zieger, B. (2021) Endothelial cells and coagulation. Cell Tissue and Research. https://link.springer.com
11. Fosse JH, Haraldsen G, Falk K and Edelmann R (2021) Endothelial Cells in Emerging Viral Infections. Frontiers in Cardiovascular Medicine. 8:619690. https://www.frontiersin.org
12. Gracia-Sancho, J., Caparrós, E., Fernández-Iglesias, A. et al. (2021) Role of liver sinusoidal endothelial cells in liver diseases. Nature Reviews Gastroenterology Hepatology. 18, 411–431. https://www.nature.com
13. Colin E. Evans, Nicholas D. Cober, Zhiyu Dai, Duncan J. Stewart, You-Yang Zhao. (2021) European Respiratory Journal; 58(5). https://erj.ersjournals.com
14. Cifarelli, V., Appak-Baskoy, S., Peche, V.S. et al. Visceral obesity and insulin resistance associate with CD36 deletion in lymphatic endothelial cells. Nature Communications. 12, 3350 (2021). https://www.nature.com
15. Wei, C., Tang, M., Xu, Z. et al. Role of endothelial cells in the regulation of mechanical microenvironment on tumor progression. Acta Mechanica Sinica. 37, 218–228 (2021). https://link.springer.com
16. Solimando AG, Da Vià MC, Leone P, et al. (2021) Halting the vicious cycle within the multiple myeloma ecosystem: blocking JAM-A on bone marrow endothelial cells restores angiogenic homeostasis and suppresses tumor progression. Haematologica. 106(7):1943-1956. https://haematologica.org
17. Vernes JM, Meng YG. (2015). Detection and Quantification of VEGF Isoforms by ELISA. Methods Mol Biol. 1332:25-37. https://link.springer.com
18. Rosendo Estrada, Guruprasad A. Giridharan, et al. (2011). Endothelial Cell Culture Model for Replication of Physiological Profiles of Pressure, Flow, Stretch, and Shear Stress in Vitro. Analytical Chemistry. 83 (8), 3170-3177. https://pubs.acs.org
19. Zvonimir S. Katusic, Noel M. Caplice, and Karl A. Nath. (2003). Nitric Oxide Synthase Gene Transfer as a Tool to Study Biology of Endothelial Cells. Arteriosclerosis, Thrombosis, and Vascular Biology. 23:1990–1994. https://www.ahajournals.org
20. Mantovani, A., Dejana, E. (1998). Endothelium, Editor(s): Peter J. Delves, Encyclopedia of Immunology (Second Edition), Elsevier, 802-806, ISBN 9780122267659 https://www.sciencedirect.com
21. Murga M, Yao L, Tosato G. (2004). Derivation of endothelial cells from CD34- umbilical cord blood. Stem Cells. 22(3):385-95. https://academic.oup.com
22. Ferrara N, Gerber HP, LeCouter J. (2003). The biology of VEGF and its receptors. Nature Medicine. 9(6):669-76. https://www.nature.com PMID: 12778165
23. Pusztaszeri MP, Seelentag W, Bosman FT. (2006) Immunohistochemical Expression of Endothelial Markers CD31, CD34, von Willebrand Factor, and Fli-1 in Normal Human Tissues. Journal of Histochemistry & Cytochemistry. 54(4):385-395. https://journals.sagepub.com

