上皮細胞
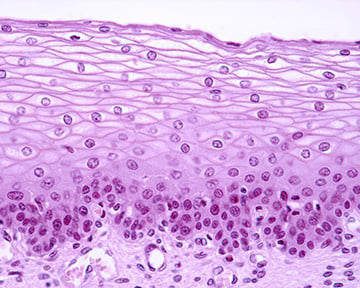
上皮細胞には多様な種類がありますが、いずれも、主要な臓器(皮膚、肺、胃腸管、泌尿生殖器系など)の腔面を覆い、物理的バリアを形成します。これによって臓器同士が接触するのを防ぎ、外部環境から隔てる役割を果たします。
形成と構造
上皮は、3つの胚芽層(外胚葉、中胚葉、内胚葉)のすべてから生じ得ます。 例えば、角化細胞は外胚葉由来であり、胃腸管を覆う上皮の細胞は内胚葉から生じ、体腔を覆う上皮は中胚葉を起源とします。上皮は急速に分裂する幹細胞から分化するため、発がんの主要な部位でもあります1。
上皮の形成は、基底膜に付着した細胞の単層として始まり、増殖因子や細胞外マトリックスがその下のメセンカイムとの界面に沈着することで、さらに成熟します。膜貫通型インテグリンのヘテロ二量体を含む多タンパク質複合体が、基底そうの上皮細胞を基底膜に接着させています。細胞間コミュニケーションは、接着結合やタイト結合、デスモソームの形成によって行われます。これにより多数の細胞が一体として機能することが可能になります。これらの細胞間接合は、上皮細胞の極性の確立に不可欠な、細胞の頂部、基底部、側面の区別にも役立ちます2。
上皮は、厚さ・固有の機能・位置に基づいて複数の型に分類されますが、分子レベル・細胞レベルの特徴には共通点もあります。上皮は主な特性に応じて、保護、分泌、吸収といった機能を担うと記述されることもありますが、この3つの機能すべてを併せ持つ場合も少なくありません。上皮は、その形状と層の数によって次のように分類されます。
- 細胞の形状:扁平、立方体、円柱状
- 細胞層:単総(1層)または重層(複数層)
- 特殊性:繊毛、移行、腺状
機能
上皮の物理的バリアは、分泌、選択的吸収、細胞間輸送、感覚知覚などの重要な保護・調節機能を果たします。また、他の特定の機能に特化したエフェクター細胞をリクルートまたは活性化し、自然免疫に寄与します。例えば、上皮は好酸球の機能を利用して、免疫応答を開始・増強し、抗炎症作用を発揮します。また、上皮細胞から分泌される特定のポリペプチド(リゾチーム、ラクトフェリン、ディフェンシンなど)と好中球から分泌されるものとの間に類似性があることも示唆されています。これは、どちらの細胞にも、これらの抗菌物質の産生を指示する遺伝子が共発現していることに起因すると考えられます3。
ほとんどの上皮細胞は一生を通じて再生されます。細胞置換の時期は上皮によって異なります。例えば、腸の上皮は5日ごとに入れ替わりますが、表皮は再生に4週間かかります。上皮の再生は、多能性幹細胞の存在に起因します。上皮幹細胞は多能性幹細胞からの発生時に運命付けられ、上皮-間葉系相互作用によって制御されます2。
上皮間葉転換(EMT)は、遺伝子発現の変化や翻訳後の調節によって上皮細胞が極性や接着性を失い、間葉系のフェノタイプを獲得する、特異な細胞プロセスです。この変化によって、上皮細胞は特殊な浸潤性と移動性を獲得し、間葉系様の性質へと転換します。この過程は、胚発生や創傷治癒などの生理的プロセスだけでなく、がん転移などの病理学的プロセスにおいても重要であることが知られています。EMTの活性化につながるシグナル伝達経路の同定は、細胞フェノタイプの可塑性や、可能な治療介入に関する新たな洞察を提供します2。
近年注目されている研究
最近の臨床・前臨床試験から、神経変性疾患の管理において、様々な種類の幹細胞を用いて失われたニューロンの再生・回復を促すことが可能であることが示唆されています。ヒト羊水上皮細胞を用いたアプローチは、腫瘍原性や免疫原性のリスクが低いだけでなく、倫理上の懸念がないことから、将来的に有望な細胞治療となる可能性があります4。
上皮細胞を研究するためのツール
細胞マーカー
細胞マーカーを用いることで、胚発生や発がん、EMT状態などの、上皮細胞の生物学的特徴の解析が可能です。従来用いられてきた上皮マーカーは上皮膜抗原(EMA/MUC1)と汎サイトケラチンですが、全ての上皮からEMAが産生されるわけではありません。上皮マーカーの消失は、EMTや特定のがんにおける転移の進行にも関連します5。上皮細胞は以下のマーカーの発現により同定されます。
細胞接着分子:上皮特異的抗原または上皮細胞接着分子(EpCAM)は、 ほとんどの健康な上皮細胞で発現していますが、上気道や腸のような粘液扁平上皮には見られません。E-カドヘリンは神経上皮を除くすべての上皮細胞で発現しています。
サイトケラチン:酸性(type A:CK9-20)と塩基性(type B:CK 1-8)の2つのサブグループから成り、通常、type Aとtype Bのヘテロ二量体を形成します。上皮細胞は、組織・臓器ごとに特徴的なサイトケラチン発現パターンを示すため、その違いを各上皮の識別に利用できます。例えばサイトケラチン15は 毛包幹細胞のマーカーです5,6。
CD66fまたは妊娠特異的 β-1糖タンパク質(PSBG-1)は、胎盤シンサイト栄養芽細胞、胎児肝臓、骨髄由来細胞株から産生されます。妊娠後期の母体血清に豊富に存在し、胎児を母体の免疫系から保護する役割を担っていると考えられています7。
| 表面マーカー | 別称 | 発現部位 |
|---|---|---|
| CD66e | CEACAM5、CEA遺伝子ファミリーの分子 | Surface, post-birth only found in tumor cells |
| CD66f | PSBG-1、CEA遺伝子ファミリーの分子 | 表面 |
| CD340 | HER2/erbB2, MLN 19 | 表面 |
| CD331 | FGFR1, BFGFR, FLT-2 | 表面 |
| CD324 | E-Cadherin, CDH1 | 表面 |
| CD326 | EpCAM, EGP314 | 表面 |
| CD318 | CDCP1, SIMA135, TRASK, gp140 | 表面 |
| CD249 | EAP、BP-1、グルタミルアミノペプチダーゼ | 表面 |
| CD118 | LIFR、白血病抑制因子受容体α | 表面 |
参考文献
1. Hinck, L., Näthke, I. (2014). Changes in cell and tissue organization in cancer of the breast and colon. Current opinion in cell biology, 26, 87–95. https://doi.org/10.1016/j.ceb.2013.11.003
2. Yang, J., Antin, P., et al. (2020) Guidelines and definitions for research on epithelial-mesenchymal transition. Nat Rev Mol Cell Biol. 2:41–352. DOI: https://doi.org/10.1038/s41580-020-0237-9
3. Ganz T. (2002). Epithelia: not just physical barriers. Proceedings of the National Academy of Sciences of the United States of America. 99(6). https://doi.org/10.1073/pnas.072073199
4. Huiming Xu, Jiaofei Zhang, et al. (2019). Therapeutic potential of Human Amniotic Epithelial cells on Injuries and Disorders in the Central Nervous System. Stem Cells International. DOI: https://doi.org/10.1155/2019/5432301
5. Guislaine Barriere, Pietro Fici, et al. (2014). Circulating tumor cells and epithelial, mesenchymal and stemness markers: characterization of cell subpopulations. ATM. 2:11. DOI: 10.3978/j.issn.2305-5839.2014.10.04
6. Zeisberg M, Neilson EG. (2009). Biomarkers for epithelial-mesenchymal transitions. J Clin Invest. 119(6):1429-37. doi: 10.1172/JCI36183.
7. Stockinger, H., Majdic, O., et al. (2003). Monoclonal Antibodies to Human Cell Surface Antigens. Current protocols in immunology, 53(1), A.4A.1–A.4A.49. https://doi.org/10.1002/0471142735.ima04as53

