第2話「ウイルスを落とす」
籔井教授 約束通り、今日は前回の到達点である「ウイルスは粒子である」というところから出発して、ウイルス粒子の超遠心機によるペレッティングへとつながって行く話、つまり「ウイルスを落とす」話をしましょう。
粒子というのは球状の物体であり、その指標は大きさと密度です。
早斐 なんか物理の授業みたい。
籔井教授 だからウイルスの物理化学的性状というのです。もっとも教科書には大きさは電子顕微鏡で見たときの直径が書いてありますが、超遠心機によるウイルスの精製という観点からは別の表し方をします。
伊藤 大きさというのは、溶液中での沈降係数(スベドベリ値:S値)であり、密度というのは、塩化セシウム溶液中での浮上密度(buoyant density) のことですね。前のインタビュー記事でも、ウイルスを含めていろいろな細胞内の粒子におけるS値と浮上密度との関係を表す図を示されていましたね(下図)。
 籔井教授 よく覚えていますね。
籔井教授 よく覚えていますね。
伊藤 以前に人から頼まれて、この図をさんざん探し回ったことがあるものですから。
籔井教授 ところが、医学部の学生さんの中には、こういう図を読むのが苦手な人が結構いるのですよ。
伊藤 えっ?
早斐 私も苦手でした。
と言うより、要するに結論として何を覚えればいいのか、ということを早くつかまなきゃいけないのよ。学生としてはね。
籔井教授 そう、ふつうの学生にとっては覚えるべき結論が重要であって、実験で得られたデータを表現した図表から情報を読み取っていくという作業にはあまり興味がないのです。
例えば、この図では、単一の物差しではなく、2つの観点からものを見て、分別しているところが肝(きも)です。X軸がショ糖密度勾配溶液中を速度ゾーン遠心法によって移動してくる粒子の位置を示し、Y軸が塩化セシウムの平衡密度勾配遠心法によって等密度になる点まで移動してくる粒子の位置を示しています。それぞれの軸が超遠心法によるウイルス分離の基本的な2つの方法の1つを示しています。
つまりどちらか1つの方法では、同じところに移動して来てしまって分けられないものが、2つを組み合わせることによって分離できるようになるところが面白いのです。
早斐 それ、タンパク質の解析に使う二次元電気泳動法と共通のところがありませんか?最初がSDSポリアクリルアミドゲル電気泳動ですから、分子の大きさ(分子量)に従って移動して、次の二次元目はタンパク質の等電点に従って移動するので、2つの方法を組み合わせることによって分離するという観点からすると同じでしょ?
籔井教授 そのとおり。精製法や分析法としては常套手段です。実験結果、あるいはもっと広く物事を、一元的でなく多角的に、せめてもう一つ別の次元で見ると分かるという考え方につながるでしょう。
伊藤 確かに、「分かる」も「分ける」も漢字で書くと同じですね。
籔井教授 分けて、分けて、とことん分けていけば物事が分かるというのは、還元主義という考え方です。私の研究哲学です。
医学も歴史的にみると還元主義的な発展をしています。古代では、病むのは患者さんという人間全体であり、病気を特定の臓器に結びつけることはありませんでした。18世紀に入ってモルガーニ(1682〜1771)というイタリア人が700例もの解剖例から「病気には病む臓器がある」という概念を初めて提唱しました。どこか「悪い臓器がある」という概念がなければ、診察といっても体のあちこちを診る(みる)必要はなく、脈を診ればよかったわけです。
19世紀になると臓器から組織、そして細胞へと細かくなり、20世紀の後半になって分子が病む、つまり人類は病気を分子のレベルで理解するレベルにやっと到達しました。このような先人の努力による医学の進歩の負の一面ということになりますが、現代の医療の中で患者さん全体を診ないお医者さんが増えたと批判されるようになりました。現在の医学教育の中では、病むのは臓器ではなく患者さんその人である、ということが強調されています。
伊藤 教授、本題に!
籔井教授 「ウイルスを落とす」とは、超遠心機によるウイルス粒子のペレッティングのことです。正式には、分画遠心法(differential centrifugation)と言います。
原理的に言えば、粒子の形と大きさで決まる沈降係数S値の差を利用して、溶液中に存在するさまざまな粒子をペレットと上清に分ける方法です。S値が大きいほど早く沈降します。
伊藤 弊社の遠心機カタログにあるベックマン博士の一口メモにS値を出す計算式があります。

早斐 あらっ、式を見るとS値には密度も影響しますね。
籔井教授 式にあるのは、ウイルス粒子の密度から溶媒(ウイルスを懸濁しているバッファー) の密度を引いた密度の差です。そもそもウイルス粒子の密度の方が、溶媒、例えばPBS(りん酸緩衝液)より大きいから沈むのです。
早斐 式を見ると粒子の直径は2乗で効くので、直径が2倍ある粒子ならばS値は4倍大きくなるのね。一方、密度の差で4倍も違う粒子はあまりなさそうなので、大きさのほうがはるかに大きくS値に影響するわけですね。
籔井教授 一方、式で溶媒の密度ρlを大きくしていくと、S値が小さくなり沈降が遅くなることがわかるでしょう。S値は沈降するまでの時間に反比例します。先ほど伊藤さんが言った、ベックマン博士の一口メモの同じページにある式を見ると、そのことが分かります。

早斐 ウイルスがペレットになるまでには、ショ糖溶液のほうがPBSよりも時間がかかるわけですね。
籔井教授 ちなみにS値に名を残すテオドール・スベドベリSvedberg(肖像写真)は分析用超遠心機の生みの親です。

テオドール・スベドベリ
籔井教授 さて、分画遠心法では、遠心条件、つまりロータを何回転でどれだけ回すかによって、ウイルスがペレットに来たり、上清に残ったりします。
伊藤 ウイルスがペレットに来れば、精製され、かつ濃縮されることになりますね。
籔井教授 いろいろな生化学的精製法の多くは精製すると薄まることが多いので、精製と濃縮が同時に行えるのは遠心法の魅力です。分画遠心法などという専門用語が大げさに感じられるように、ペレッティングは簡単にみえます。また、精製段階でより高度な密度勾配遠心法にのせる前のいわば前処理的な段階です。しかし現実には、ウイルスがペレットに来るか上清に残るかは、純粋にウイルスの沈降係数だけでは決まりません。
早斐 沈降係数だけでは決まらないなんて、本当にありですか?まさか、ウイルスが低速遠心でペレットに来ることはないでしょう。
籔井教授 それがあるのです。タネを明かしましょう。
出発材料が糞便(第1話でお話したように、ロタウイルスは便中に排泄されます。)であろうと感染細胞であろうと、ロタウイルス粒子はバラバラに単独で溶液中に浮かんでいるわけではありません。
ウイルスは1つ1つの粒子が遊離した状態で存在するわけではありません。
どんな状態で存在しているか、想像をたくましくしよう。
むしろ塊をつくっているのが普通でしょう。ロタウイルスが感染細胞のデブリにくっついていれば、最初の低速遠心(私たちは「ゴミ取り遠心」と言っています。)の段階で、細胞の残骸とともに多くがペレットに行ってしまいます。沈降係数から考えて、ロタウイルス粒子のすべてが低速遠心後の上清に残ると思ってはいけません。この低速遠心でのペレッティングの段階で、多くが失われると言っても過言ではないと思います。ですから、ロタウイルス粒子がサンプル中にどんな状態で存在しているか、想像することが大切です。
精製の初期段階でのロスは起こりやすく、後からはばん回できません。
ウイルスを感染させた培養細胞から回収する場合、遠心前に感染細胞を凍結融解の繰り返しや超音波処理で十分壊して、ウイルスを「細胞のしがらみ」から解放してあげてください。
早斐 なるほど、遊離のウイルス粒子であれば全く沈降しないような、低速の遠心でもペレットの方に行ってしまうことがあるのですね。
籔井教授 感染細胞内にあり、細胞中の膜構造物などと絡み合っているロタウイルスをできるだけ回収するために、凍結融解をきちんと3回繰り返すことが大切です。さらに有機溶媒を使って脂質成分を分離したり、超音波で細かく破砕したりするなど、いろいろ工夫のしようはあります。
伊藤 具体的にはどんな条件でゴミ取り遠心をするのですか?
籔井教授 ゴミ取り遠心では超遠心機ではなく、高速冷却遠心機 Avanti HP-25 (2001年販売終了、後続製品:Avanti JXN-26、Avanti JXN-30等) と固定角ロータ JA-14を使います。

| 最高回転数 (rpm) |
最大遠心力 (xg) |
k-ファクタ | チューブサイズ (mm) |
公称容量 (本数 × mL) |
| 14,000 | 30,100 | 1,764 | 62×120 | 6×250 |
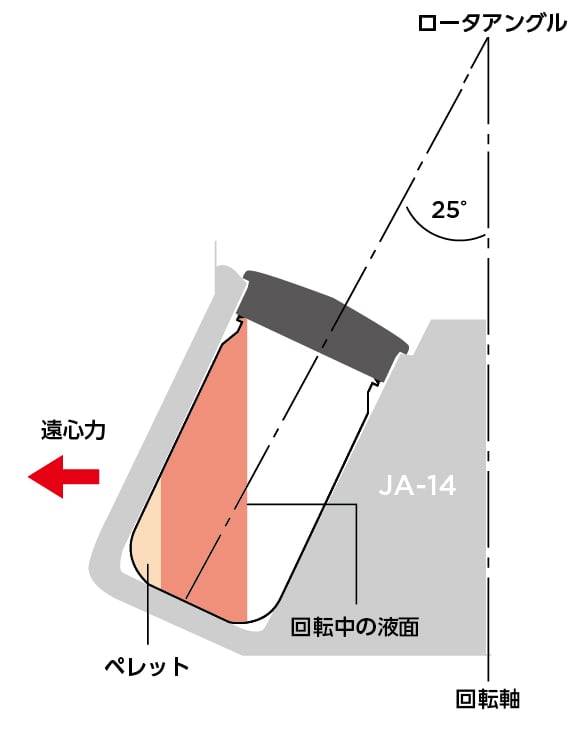 籔井教授 このロータには、250 mLのPCボトルキャップアセンブリ6本をロードできますが、250 mLのPCボトルキャップアセンブリには150 mL以上入れてはいけません(図)。それ以上入れると、ロータが回転しているときに溶液がキャップに付着してしまいます。
籔井教授 このロータには、250 mLのPCボトルキャップアセンブリ6本をロードできますが、250 mLのPCボトルキャップアセンブリには150 mL以上入れてはいけません(図)。それ以上入れると、ロータが回転しているときに溶液がキャップに付着してしまいます。
私たちは、実験上の都合でウイルス株1つを感染培養細胞から精製するのに300 mLを単位としています。ですからPCボトルを2 本使います。遠心条件は、最初に3,000 rpm 10 分、そのまま続けて10,000 rpm 10 分です。
伊藤 先生の実験室を拝見させていただいたとき、固定角ロータ JA-14.50もお持ちでしたが、あれを使えば、50 mLのディスポーザブルのコニカルチューブ6本でいけるのではないですか?

| 最高回転数 (rpm) |
最大遠心力 (xg) |
k-ファクタ | チューブサイズ (mm) |
公称容量 (本数 × mL) |
| 14,000 | 35,000 | 787 | 30×115 | 16×50 |
籔井教授 JA-14.50は、ディスポーザブルのコニカルチューブがそのまま使えるので非常に便利です。第1に、遠心機専用のチューブと比較すると価格は数十分の1のです。第2に、ウイルスですので使用後の滅菌は必要ですが、洗浄して再利用する必要はありません。第3に、私たちはウイルスをハーベストするとき、培養液を50 mLのコニカルチューブに入れ表面とキャップにウイルス株名を書いて凍結保存します。解凍してそのまま遠心に回せます。これは、スタートの段階でのサンプルの取り違えのリスクを大きく減らします。私たちは分子疫学的な研究を行っています。疫学は集団をあつかいます。ウイルスの集団です。つまり多数のウイルス株を扱うので、疫学で個人を取り違えると致命的なのと同じように、サンプルの取り違えは致命的です。
一方、問題が1つあります。コニカルチューブはメーカーを選ばないと、フルに50 mLを入れても10,000 rpm 10 分に耐えられず破損する事故が起こります。破損は何度も経験しました。ロータが汚染してしまうので、その後の始末が大変です。

低~中程度のチューブのひび割れの例
伊藤 汚染の後始末はどうするのですか?
籔井教授 ロタウイルスは95%のエタノールで感染性が著しく低下します。95%のエタノールをふんだんにしみこませたペーパータオルを毎回取り替え、少なくとも3~4回拭きます。使用後のペーパータオルはオートクレーブで滅菌します。その後に、ロータを流しに持っていき、お湯を流しながら薄めた洗剤(私たちは家庭用の中性洗剤を使っています。)を使ってロータ内を洗い流し、流水できれいにした後、水分を丁寧にペーパータオルでふき取り、最後にねじの部分にスピンコートを塗っておきます。慣れてくると、自慢にはなりませんが、30分くらいで終わります。でも精神的ダメージが大きいですね。
遠心後にロータの穴の底に液滴があったら、面倒でも必ずふき取り、洗っておくこと。
一生のうちには、この習慣のおかげで助かることがきっとあるでしょう。
伊藤 ここからいよいよ超遠心機を使ってロタウイルスを濃縮して回収するわけですね。
籔井教授 今後の流れは、①分画遠心によるペレッティング、②ショ糖密度勾配速度ゾーン遠心法(ルーチンにはショ糖クッション遠心法を使います。)、③塩化セシウム平衡密度勾配遠心法というステップを経て、精製ロタウイルス粒子を回収します。
②と③のステップの後でも、ショ糖や塩化セシウムを除くために分画遠心によるペレッティングを行います。
超遠心によるウイルス精製の流れ
① 分画遠心によるペレッティング
↓
② ショ糖密度勾配速度ゾーン遠心法
↓
③ 塩化セシウム平衡密度勾配遠心法
ですから、ペレッティングはウイルス粒子を扱うときの基本操作です。遺伝子組み換え実験で核酸を扱うときの、エタノール沈殿に相当する基本操作です。
ウイルスのペレッティングによる濃縮は、ウイルス粒子を扱うときの基本操作です。
さて、次のステップで超遠心によるペレッティングにまわるのは、高速冷却遠心で細胞のデブリをペレットに落とした後の上清300 mLです。私たちがロタウイルスのペレッティングに最も頻繁に使うのは、固定角ロータ Type 45 Tiです。このロータ用のPCボトルキャップアセンブリの公称容量は80 mLですが、1本あたり50 mLずつ分注するのが適量です。それで、1回の超遠心で回せる容量は6本ロードし、300 mLになります。

| 最高回転数 (rpm) |
最大遠心力 (xg) |
k-ファクタ | チューブサイズ (mm) |
公称容量 (本数 × mL) |
| 45,000 | 235,000 | 133 | 38×102 | 6×94 |
ウイルスのペレッティングによる濃縮にあたって、私がいつも新しい学生さんに注意するポイントがあります。分画遠心法でのペレッティングでは10倍を目安にして濃縮します。新人の学生さんは、ペレットを実に少量バッファーに懸濁する傾向があります。絶対に濃縮しすぎてはいけません。
ペレッティングの原則(1):
濃縮しすぎに注意!目安はペレットを遠心前の容量の10分の一くらいの溶液に懸濁することです。
さて、遠心後にチューブを見ると、直径1cm程度の小さな白いペレットができています。ペレットは1 mLのバッファーに懸濁できます。2 mLであれば十分という感じです。それを1 本あたり5 mLとするのには、薄めすぎの不安にかられ、ちょっと勇気がいります。
伊藤 この遠心操作、ウイルスのペレッティングによる濃縮では、特に難しい問題があるようにはみえませんが、何か注意すべきことはありますか?
籔井教授 精製の後半で行う、ショ糖密度勾配速度ゾーン遠心や塩化セシウムでの平衡密度勾配遠心となると、誰でも細心の注意を払って実験します。もちろんフラクションのとり方の上手・下手はあります。ところが、最初の段階は操作は難しくない一方、ボリュームが大きいので、あまりよく考えずに右から左へとこなしていく「やっつけ作業」的になりがちです。
早斐 あるあるですね。
籔井教授 ところがペレットを懸濁するときに、どれだけきちんとやるかは収量にかなりクリティカルに効いてくると思います。
早斐 そういうことは、プロトコールにはあまり詳しく書いていないですよね。
籔井教授 経験を積めば積むほど、最初のなんでもないように見える段階が重要だということがわかります。
早斐 ペレットを懸濁するときにも注意があるんですか?
籔井教授 初心者はこの作業に時間をかけません。1つの遠心から次の遠心への「乗り継ぎ」的なところで、ちゃんとした仕事をすべき実験の1ステップであるとは考えないようです。だから、実験計画の中でもロスタイムみたいな扱いです。
早斐 そういうつもりはないけれども、プロトコールの中では、たいてい「ペレットをxx mLのPBSに懸濁する」としか書いていないじゃないですか。だから、実験計画を立てるときの時間計算からつい抜いてしまうのよ。
籔井教授 ペレットを懸濁するコツは、できるだけ細かく均一な懸濁液を作り、この乳白色に懸濁した液をちょっと立てておいてもすぐに目に見える沈殿ができてこないことです。
ペレッティングの原則(2):
ペレットを懸濁するときは、あせらず時間をかけて、しっかりと。できるだけ細かく均一な懸濁液を作ること。
伊藤 具体的にはどうしているのですか?
籔井教授 先ほどの固定角ロータ Type 45 Ti用のPCボトルキャップアセンブリ中の50 mLの溶液からできたペレットを懸濁する場合で説明しましょう。
- PBSを1 mL加え、細菌検査室で使うプラスチック製のディスポーザブルループ(古くは白金耳と言った)で突いて、ていねいに崩します。ついで、これもプラスチック製のディスポーザブルのものですが、滅菌スポイトで集めて1本の50 mLファルコンチューブにまとめます(全部で6本ありますから)。 10 mLのディスポーザブル注射筒に18ゲージの針をつけ、懸濁液の中の塊が見えなくなり、するすると注射筒に液が出入りするようにします。ここで無理に力を入れると、注射筒から針がはずれ、懸濁液が飛散するという実に悲惨な状況になります(経験しました)。
- 注射筒はそのままで、針を21ゲージに交換して同様にします。
- もとのPCボトルに1.5 ~2 mLのPBSを加えて、ペレットのあった辺りを、さらにループでこすりながら洗います。この洗い液(9~12mL)を例の滅菌スポイトを使って、最初の50 mLファルコンチューブにまとめます(ここで容量は15 ~18 mLになります)。滅菌スポイトを使うのは口径が大きいからです。ピペットチップだと詰まることがあります。
- 注射筒を10 mLから25 mLのものに交換し、22ゲージのカテラン針をつけ、するすると注射筒に液が出入りするようになるまで、ていねいに懸濁します。ここでカテラン針に交換するのは、針の長さが60 mmあるからです。長さ38 mmの通常の針では、針先が50 mLチューブの底に届かないからです。
- もう1本の50 mLファルコンチューブを用意し、⑤の懸濁液の半量(7.5~9 mL)を移し、それぞれに、16~17 mLのPBSを加えます。
- 25ゲージのカテラン針をつけた25 mLの注射筒を使って、するすると注射筒に液が出入りするようになるまで、ていねいに懸濁します。
ただ、私の教室でも誰もが同じようにやっていたわけではありません。むしろ、自分でいろいろ工夫していいと思います。できるだけ細かく均一な懸濁液を作らなければいけないという必要性が理解できれば、大丈夫だと思います。
 伊藤 ところで、1点教えて頂きたいのですが、ペレットの懸濁が不十分な状態で②のステップ(ショ糖密度クッション遠心)を行った場合は、どのようになりますでしょうか?この写真は中込治教授のインタビュー記事「超遠心法によるウイルス精製の基礎」に掲載のものなので、実験がうまくいった場合であると思いますが、懸濁が不適切だと不純物層にウイルスが残ってしまうのでしょうか?それとも、ショ糖密度クッション遠心ではウイルス粗画分に行くが、次の塩化セシウムでの平衡密度勾配遠心の際にバンド形成がうまくいかなくなるなどの問題が起きるのでしょうか?
伊藤 ところで、1点教えて頂きたいのですが、ペレットの懸濁が不十分な状態で②のステップ(ショ糖密度クッション遠心)を行った場合は、どのようになりますでしょうか?この写真は中込治教授のインタビュー記事「超遠心法によるウイルス精製の基礎」に掲載のものなので、実験がうまくいった場合であると思いますが、懸濁が不適切だと不純物層にウイルスが残ってしまうのでしょうか?それとも、ショ糖密度クッション遠心ではウイルス粗画分に行くが、次の塩化セシウムでの平衡密度勾配遠心の際にバンド形成がうまくいかなくなるなどの問題が起きるのでしょうか?
勉強不足でもうしわけございませんが、教えて頂けますと助かります。
籔井教授 鋭い質問で感心しました。ここを突かれると痛いですね。この場合も不純物層にウイルスが残っています。完全になくすことはできないのですが、多いほうです。それには理由があります。この実験は1から10まで中込教授自身が、時間的制約のある中で、ありあわせのサンプルを使って、貴社のインタビュー記事の写真に使うために行ったものです。今のご時勢ですから、このような実験をスタッフや大学院生にやってもらうわけにはいかなかったのでしょう。それで収量などは無視しています。しかし実験をやっていく上で、現実的に考える要素が含まれていますので、第3話でショ糖密度クッション遠心(ショ糖密度勾配速度ゾーン遠心)と塩化セシウムでの平衡密度勾配遠心によるお話をするときに、少し突っ込んで取り上げてみましょう。
関連ページ
|
|
超遠心機 ベックマン・コールターは1947年に初めて超遠心機(超遠心分離機)を販売開始し、現在では高い遠心力・回転数はもちろん、バイオセーフティモデルやリモートコントロール機能などを備えた超遠心機を取り揃えております。様々なチューブや容量に対応するロータやアクセサリ類も取り揃え、ウイルスの高純度精製やエクソソーム分離、その他幅広いアプリケーションのご要望にお応えします。 |


