超遠心分離法によるエクソソームの高純度精製
背景
細胞外小胞(EV)は、ほぼすべての生細胞から分泌される不均一な脂質二重膜構造を有する小胞の総称です。EVは様々なカーゴを輸送し、細胞間コミュニケーションや生理プロセスにおいて重要な役割を果たしています。EVはあらゆる生細胞から自然に分泌されますが、発生機序と直径が異なります。エクソソーム、マイクロベシクル、アポトーシス体はすべてEVです1。エクソソームは、バイオマーカーや治療薬として臨床で非常に有望視されています2-4。
課題
エクソソームはサイズ、組成、機能が不均一であるため、単離に利用できる技術の多くは、単離後の特性評価やアプリケーションには適していません1。
ソリューション
超遠心分離法は分離能が高く、エクソソームの特定のサブポピュレーションを高い再現性で単離できます。超遠心分離法は最もよく用いられるEV精製技術であり、広くゴールドスタンダードと認識されています5-6。
エクソソーム精製法
- 分画超遠心法では、段階的に遠心力を上げて遠心を複数回行い、コンタミネーション物質を取り除き、最終的にEVを沈殿物として回収します。この後、遠心による精製を行います。
- 密度クッション分画超遠心法は、チューブ底部に高密度素材(スクロースやヨウジキサノール[密度勾配形成溶媒OptiPrepTM]など)の「クッション」を入れて通常の分画超遠心法を行います。クッションを使用することで、ペレットがより穏やかに形成されるため、エクソソームの形態・完全性・機能がよりよく維持されます。密度勾配超遠心法(DGUC)は、エクソソームの物理的性質(サイズ、形状、質量、密度)の違いによりエクソソームを分離する高分解能精製法です。
- 等密度勾配超遠心法ではサンプルチューブに密度勾配溶質を加え、連続した密度勾配が形成されるまで高速で遠心します。すると、エクソソームは周囲の媒体と浮力密度が等しくなる位置に集まります。
- 平衡密度勾配超遠心法は等密度超遠心法に似ていますが、連続的な密度勾配ではなく、特定の密度の層が形成されます。その結果、遠心により特定のエクソソームポピュレーションが特定の離散的密度ゾーンに分布します。
- レートゾーナル超遠心法では、初期の線形勾配の上にサンプルを重層します。遠心を開始すると、エクソソームは個々の沈降係数(s値)に応じて異なる速度で沈降し始めます。つまり、粒子はチューブの底に向かって移動しますが、重くて高密度、かつ球状の粒子は、移動速度が速くなります。
使用した3種類の細胞株と培地の種類 は下表の通りです。
| ユースケース | 角度 | 例 | 沈降経路長 (速度) |
|
|---|---|---|---|---|
| スウィング | スウィングロータは沈降経路長が最も長いため、レートゾーナル法によるエクソソーム分離に最適です。スウィングロータは、質量が非常に小さいサンプルのペレッティングにおいて、可視性とペレット安定性を最大限に高めるのに有用です。 | 90° |  |
 |
| 固定角 | 固定角ロータは汎用性が高く、レートゾーナル法を除くすべてのエクソソーム精製法に使用できます。固定角ロータは、大量のペレッティング、特にサンプルが目に見えるほど十分な量である場合に適しています。 | 20-30° |  |
 |
| 近垂直 | 近垂直ロータは、浮遊または沈降しているコンタミネーション物質がわずかに含まれる可能性のある、純度の低いサンプルを密度によって分離するのに適しています。 | 7-10° |  |
 |
| 垂直 | 垂直ロータは、密度勾配形成および高分解能での密度によるエクソソームの分離に最も適したオプションです。 | 0° |  |
 |
エクソソーム精製用チューブ
ほとんどのチューブは様々な素材のものが用意されていますが、ポリプロピレン製とウルトラクリア製が第一選択です。ポリプロピレン製チューブはピアシングが簡単で、ウルトラクリアチューブは中が見えやすいことが特徴です。エクソソームの精製には、透明なウルトラクリアチューブをお勧めします。
 |
Quick-Seal |
 |
OptiSeal |
 |
オープントップ |
 |
キャップ付きオープントップ |
エクソソーム精製プロトコル*
1. 分画超遠心法(DUC)
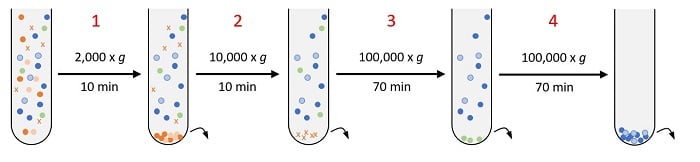
  |
細胞/死細胞 |  |
細胞片 |  |
大きな小胞 |  |
低密度のエクソソーム |  |
高密度のエクソソーム |
Xie 20227 および Gall 20208のプロトコルを改変:
- 細胞全体を取り除きます。従って、エクソソームをどこから得たか(CHO細胞培養、血液など)によって、大きく異なります。特定の種類の細胞の除去に適切な速度は、文献を参照してください。
- 細胞片を取り除きます。
- アポトーシス小体およびマイクロベシクルを取り除きます。
- エクソソームを単離します。この段階ではまだ、サンプルに大きなベシクルが含まれているかもしれませんが、取り出したエクソソームは濃縮されています。
このプロトコルの改善案:
- 沈降経路長を短くする(kファクターの向上)
- コニカルチューブを使用すれば、ペレット回収率が上がる場合がある。
*このプロトコルは、すべての標準固定角ロータおよびスウィングロータで実行できます。
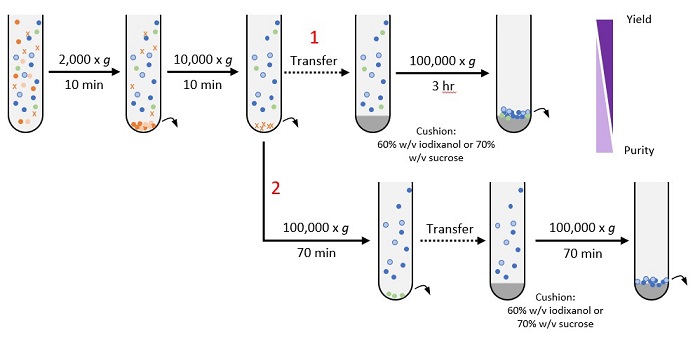
2. 密度クッション分画超遠心法*(Cushioned DUC)
  |
細胞/死細胞 |  |
細胞片 |  |
大きな小胞 |  |
低密度のエクソソーム |  |
高密度のエクソソーム |
Duong 20199のプロトコルを改変:
密度クッション分画超遠心法は、エクソソームの形態と機能をよりよく維持するため、高密度クッションでペレット処理されることを除けば、標準的な分画超遠心法とほぼ同じです。このプロトコルは、ハンズオンタイム(手作業にかかる時間)と単離されたエクソソーム品質のバランスが良いものです。注目すべきは、(1)より収率の高いプロトコルと、(2)より高純度のエクソソームが得られるプロトコルの2つのバージョンが提示されていることです。
このプロトコルの改善案:
- 沈降経路長を短くする(kファクターの向上)。
*このプロトコルは、すべての標準固定角ロータおよびスウィングロータで実行できます。
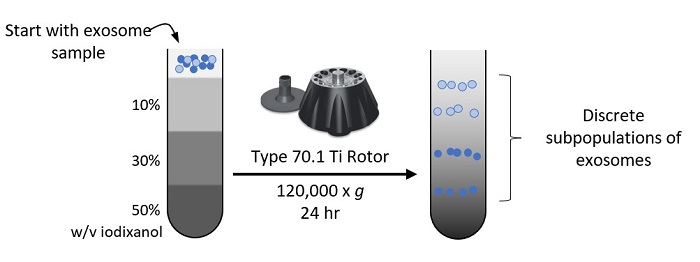
3. 密度勾配超遠心法†(Isopycnic DGUC)
  |
細胞/死細胞 |  |
細胞片 |  |
大きな小胞 |  |
低密度のエクソソーム |  |
高密度のエクソソーム |
Onodi 201810のプロトコルを改変:
等密度勾配超遠心法では、高密度の溶質(ヨウジキサノールなど)の入ったチューブに、クルードなエクソソームサンプルを入れます。平衡に達し連続した密度勾配が形成されるまで、チューブを遠心します。ステップ数、各ステップの体積、サンプルの位置(層の上、間、下)、サンプルの開始密度、遠心速度・遠心時間、ロータの種類など、多くの変更が可能です。エクソソームの浮力密度は通常1.08~1.20 g/mL11、12で、使用する密度勾配形成材料によって変わります。
このプロトコルの改善案:
- 垂直ロータを使用して沈降経路長を短くし、遠心時間を短縮する
- 回転数を上げて遠心時間を短縮する*
- マルチスピードプロトコルを用いて効率を向上させる(まず高速で平衡状態に到達した後、低速で勾配を平坦にして分解能を上げる)
- あらかじめ勾配層を作成しておくことで遠心時間を短縮する(手作業での調製にかかる時間とのトレードオフ)
*このプロトコルは、すべての標準固定角ロータおよびスウィングロータで実行できます。
†遠心を安全に実行できる速度は、開始密度とロータによって決まります。高密度材料を使用する場合の安全な遠心速度は、ロータの取扱説明書(IFU)を参照して判断してください。
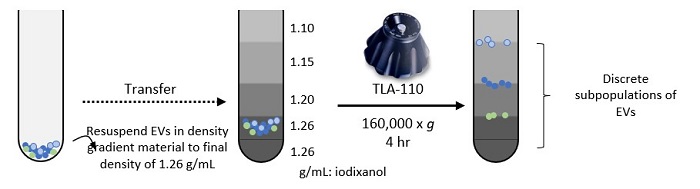
4. 平衡密度勾配超遠心法(Equilibrium Zonal DGUC)
  |
細胞/死細胞 |  |
細胞片 |  |
大きな小胞 |  |
低密度のエクソソーム |  |
高密度のエクソソーム |
Iwai 201613のプロトコルを改変:
平衡密度勾配超遠心法では、クルードなエクソソームサンプルを、密度が徐々に高くなるよう層を形成したチューブに入れます。遠心すると、エクソソームは周囲の溶液の浮力密度が自らの浮力密度と等しいチューブ内の位置(通常は2つのステップ間の境界面)に移動します。等密度勾配超遠心法と同様、この分離法にも多くのバリエーションがあります。ですが、連続した密度勾配が形成される前に実験を停止する(つまり、異なる密度レベルのステップが維持される)点が等密度勾配超遠心法と異なります。この例では、エクソソームは前の工程でペレット処理され、特定の密度の緩衝溶液に直接再懸濁されますが、これは絶対的な要件ではありません。
このプロトコルの改善案:
- 垂直(または近垂直)ロータを使用して沈降経路長を短くし、遠心時間を短縮する*
- 回転数を上げ遠心時間を短縮する*
*安全に遠心できる速度は、開始密度とロータによって決まります。高密度材料を使用する場合の安全な遠心速度は、ロータの取扱説明書(IFU)を参照して判断してください。
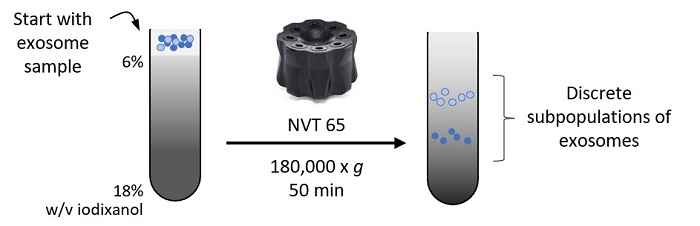
5. レートゾーナル密度勾配超遠心法(Rate Zonal DGUC)
  |
細胞/死細胞 |  |
細胞片 |  |
大きな小胞 |  |
低密度のエクソソーム |  |
高密度のエクソソーム |
Vaillancourt 202114のプロトコルを改変:
レートゾーナル勾配超遠心法では、あらかじめ作成した連続密度勾配の上に、クルードなエクソソームサンプルを重層します。遠心すると、エクソソームは個々の沈降係数に応じて異なる速度で沈降します。
このプロトコルの改善案:
- スウィングロータを使用して沈降経路長を長くし、分解能を高める(ただし、遠心時間が長くなります)。
- 回転数を上げて遠心時間を短縮する*
エクソソーム精製に適した超遠心機セットアップの選択†
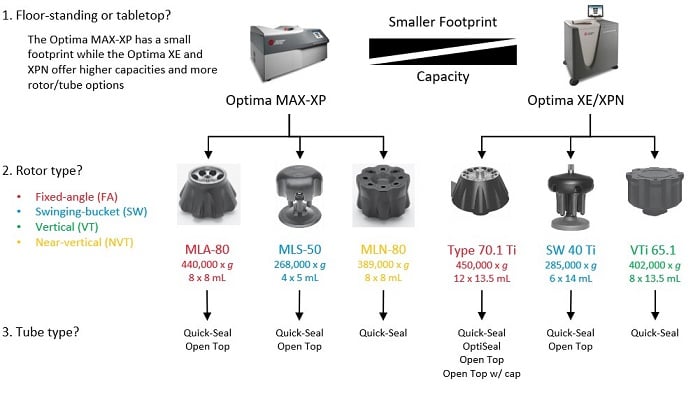
安全に遠心できる速度は、開始密度とロータによって決まります。高密度材料を使用する場合の安全な遠心速度は、ロータの取扱説明書(IFU)を参照して判断してください。
†これらはロータおよびチューブのみに対する推奨です。対応するロータおよびチューブの完全なリストについては、超遠心機カタログを参照してください。一部のチューブでは、特定のロータを使用にアダプタが必要な場合があります。
超遠心法によるエクソソーム精製の比較

表中に示す値は、標準的なプロトコルを使用した場合に、方向性を示すための目安となる数値として使用しています。
*FA:固定角ロータ、SW:スウィングロータ、VT:垂直ロータ
ベックマン・コールター ライフサイエンスの超遠心機のラインナップはこちらをご確認ください。
エクソソームについてさらに詳しく。
参考文献
- Thery, et al. (2018). J Extracell Vesicles, 7(1). DOI: 10.1080/20013078.2018.1535750
- Van Niel, et al. (2018). Nat Rev Mol Cell Biol, 19(4). DOI: 10.1038/nrm.2017.125
- Zhang, et al. (2019). Cell Biosci, 9:19. DOI: 10.1186/s13578-019-0282-2
- Kakarla, et al. (2020). Exp Mol Med, 52:1-6. DOI: 10.1038/s12276-019-0362-8
- Saenz-Cuesta, et al. (2015). Front Immunol, 6, 50. DOI: 10.3389/fimmu.2015.00050
- Konoshenko, et al. (2018). Biomed Res Int, 8545347. DOI: 10.1155/2018/8545347
- Xie, et al. (2022). Glob Chall, 6, 2100131. DOI: 10.1002/gch2.202100131
- Gall, et al. (2020). Skelet Muscle, 10(1). DOI: 10.1186/s13395-020-00238-1
- Duong, et al. (2019). Plos One, 14(4). DOI: 10.1371/journal.pone.0215324
- Onodi, et al. (2018). Front Physiol, 9:1479. DOI: 10.3389/fphys.2018.01479
- Vilas Shelke, et al. (2019). J Extracell Vesicles, 8(1). DOI: 10.1080/20013078.2019.1650458
- Webber, et al. (2010). Cancer Res, 70(23). DOI: 10.1158/0008-5472.CAN-10-1722
- Iwai, et al. (2016). J Extracell Vesicles, 5:30829. DOI: 10.3402/jev.v5.30829
- Vaillancourt, et al. (2021). Pathogens, 10(5). DOI: 10.3390/pathogens10050526


