CytoFLEX SRTセルソーターによる ミックスモードソーティング
目的
- 一般的なソート用語を説明します。
- CytoFLEX SRTに搭載されている各種ソートティングモードについて説明します。
- ミックスモードソーティングの有用性を説明します。
Introduction
セルソーターは、細胞懸濁液から目的の細胞集団を物理的に分離できる装置です。セルソーターは、高感度フローサイトメトリー分析装置とソーティング装置を組み合わせたものです。分析コンポーネントは、細胞膜表面または細胞内タンパク質の有無により、細胞の識別を行います。また、細胞をタンパク質発現の分布に基づいて分析またはソーティングすることにより、活性化状態やタンパク質の発現に基づいたより細かな分類が可能です。ターゲットとなる集団が選択されると、ソフトウエアとソーティング装置は、目的の粒子(細胞)を含む液滴を適切な容器に分取します。ソーティングにより高い陽性率に濃縮された細胞集団を得ることができ、ゲノミクス、養子細胞移植(ACT)、培養、プロテオミクス、イメージングなどの、さまざまな研究に使用されます。
CytoFLEX SRTは、液滴荷電方式のソーターです。使用されているソーティング装置は、インクジェットプリンターを動作させる装置に似ています。CytoFLEX SRTでは、細胞はフローセル内で検出された後、ストリームに乗ってフローセルを出ます。そのストリームは、フローセルに取り付けられた振動子からの振動エネルギーを受けます。この上下振動によってストリームが液滴に分割されます(図1)。この上下振動の周波数(Hz)は、液滴の形成速度を表し、この値は日々わずかに変化する可能性があります。対象のイベント(細胞)が検出されると、装置はそのイベントがストリーム上の最後の液滴になる直前の液滴(ラスト アッタチド ドロップ)に入るまで待機します。ストリームは液滴になる直前に+またはーに帯電され、その時点で液滴になった液滴が荷電された状態になります。残りのストリームはグランドの電位に戻ります。帯電した液滴は、1対の+またはーに帯電したプレートの間を通過すると、反対の電荷を持つプレートに向かって引っ張られ、任意のキャッチャーに回収されます。

図1. 液滴形成の図
周波数のHz に注目してください。これは、液滴の形成速度でもあります。ラスト アッタチド ドロップは赤い線の真上にあり、電荷の対象となる液滴です。
ソートは、続くアッセイに応じて、望ましい純度や収量が異なる場合があります。これは、適切なソーティングモードを選択することで対処できます。このアプリケーションノートでは、セルソーターCytoFLEX SRTのさまざまなソーティングモードを定義し、説明します。また、いくつかの一般的なソート用語についても説明します。
ソート用語集
ソートロジック(Sort Logic)
ブール(AND / NOT)または領域とゲートの階層ロジックの組み合わせで、イベントがポジティブ(ソートに必要)かどうかを判別します。ソートロジックの範囲外のイベントは、ネガティブイベントとみなされます。ソートモードによっては、ネガティブイベントはコンタミとみなされ、ポジティブイベントがアボートされる可能性があります。領域は、1つのパラメータ(ヒストグラム)または2つのパラメータ(ドットプロット)のいずれかで定義されます。ゲートは、領域のブール値の組み合わせです。階層ゲートは、入れ子になった母集団(母集団内の母集団内の母集団)から作成されます。CytoFLEX SRTは、ブールゲートと階層ゲートの両方を作成します。ソートロジックにどのゲートを適用するかは、ユーザーが定義します。
ソートモード(Sort Mode)
ソートモードは、液滴を帯電させたり偏向させたりするタイミングを決定するためにソフトウエアに与えられるコマンドです。ソートモードは、ソートロジックを使用して選択された対象粒子(細胞)へのコンタミ(対象外の粒子)の近接性に基づいて、ソートされた細胞の最終的な収量と純度を決定する上で重要な役割を果たします。
ソートエンベロープ(Sort Envelope)
ソートドロップエンベロープは、液滴内のポジティブイベントの位置に基づいて、ソートされる液滴の数を定義します。エンベロープの決定を容易にするために、CytExpert SRTには、一般的なソーティングのために事前定義されたモード/エンベロープの組み合わせがいくつか用意されています。
アボート(Abort)
ソートロジックの要件を満たしているが、ソートガードバンド(Sort Guard Band)内にコンタミネーション物質が含まれていたイベントです(ソートモードに基づいてソートするには近すぎる場合)。多くの場合、これらのアボートイベントは廃棄物として処理され、回収することはできません。ただし、CytoFLEX SRTでは、これらのイベントを別のキャッチャーに回収し、培養、再ソート、または更なる分析を行うことができます。
効率(Efficiency)
アボートされたイベントの数を示す指標。(ソートされた液滴)/(ソートされた液滴+アボートされた液滴)×100%で算出されるパーセンテージとして表されます。パーセンテージが高いほど、ソートでアボートされたイベントが少ないことを意味します。均一なシングルセルの懸濁液と適切なイベントレートの場合、90%以上の効率を達成できます。サンプル中の凝集塊、高いイベントレート、およびデブリは全て、効率を低下させます。
回収率(Recovery)
装置がソートされたと報告したイベント(細胞)の推定数に基づいて、実際に回収されたイベント(細胞)のカウントのパーセントを示します。目視によるカウントや体積カウントビーズを使用したサンプルの実行など、いくつかの方法で推定することができます。
収率(Yield)
ソート開始時のサンプルに含まれる細胞の推定数に基づいた収率は、ソートされ、続く実験に使用に戻された細胞の割合を示します。収率=(コレクションチューブ内のイベント数×純度)/(開始チューブ内の細胞の総数×ターゲット細胞のパーセント)×100%として計算されます。
ソーティングモードの定義
選択した母集団は、必要な出力に応じて3つの異なるモードでソーティングすることができます。
Enrichモード(Enrich Mode)
Enrichモードは、ソートの回収率が最も重要な場合に使用します。このモードを使用すると、全てのポジティブイベント(ソートロジックを満たすイベント)がソートされます。
- 純度よりも回収率が重要な場合に使用します。
- ソートされる液滴内やその近くにネガティブイベント(ソートロジックの範囲外のイベント、コンタミ)があっても、全てのソートロジックのイベントがソートされます。
- このモードでは、ネガティブイベントや同時通過イベントのアボートが発生しないため、効率は常に100%になります。
(ソートされた液滴)/(ソートされた液滴+アボートされた液滴)×100% - 効率と回収率は最も高い一方で、純度は最も低くなります。純度は、イベントレートの増加に伴って低下し、液滴生成率に近づきます。
Purityモード(Purity Mode)
Purityモードは、ソートの純度が最も重要な場合に使用します。ポジティブイベントの近くにネガティブイベントがあると、ポジティブイベントのみを含む液滴をソートできる可能性が低くなり、その液滴はアボートに指定されたストリーム(廃液または別のソートストリーム)に送られます。
純度が回収率よりも重要な場合に使用します。
- ソートされる液滴には、ソートロジックに適合するイベントのみが含まれます。
- 液滴にネガティブイベントが含まれている場合はアボートされます。
- 隣接する液滴の直近のエッジ(15%)にコンタミネーションイベントが含まれている場合、最初の液滴はアボートされます。 CytoFLEX SRTでは、これをソートガードバンド(Sort Guard Band)と呼び、必要に応じてより厳密に調整することができます。
- イベントレートが上昇すると、隣接する液滴のプライマリまたはニアエッジにネガティブイベントが発生する可能性が高くなるため、アボートレートも上昇します。
Singleモード(Single Mode)
Singleモードは、ソートにおいて、1滴につき1つのポジティブイベントを得ることが最も重要である場合に使用します。このモードは、クローニングやオミクスアプリケーションなどのシングルセルアプリケーションのプレートソーティングで最もよく使用されます。
- Singleモードでは、1つの液滴に1つのポジティブイベントを含むことが、最も重要になります。
- 回収率は低くなりますが、純度は高く保たれます。
- ドロップソートには、単一のポジティブイベントのみが含まれ、ネガティブイベントは含まれません。
- 隣接する液滴の直近のエッジ(15%)にポジティブイベントまたはネガティブイベントが含まれている場合、最初の液滴はアボートされます。
- イベントレートが上昇すると、隣接する液滴のプライマリまたはニアエッジにネガティブイベントが発生する可能性が高くなるため、アボートレートも上昇します。
- クローニングを目的としたシングルセルのプレート/スライドへの定着に最もよく使用されます。
ミックスモードソーティングの事例
PurityおよびEnrichモードソーティングの使用
ミックスモードソーティングでは、ソート実験に高い柔軟性を持たせることができます。一例として、費用やサンプルの希少性などの制約のために、アボートで失うことができない希少な集団をソートで濃縮する必要があるケースです。ここでは、マルチカラーパネルでプロセスコントロール製品を染色し、ソートされた細胞集団の結果に対する異なるソートモードの影響を示します。図2は、ソート前のサンプルの結果を示しています。
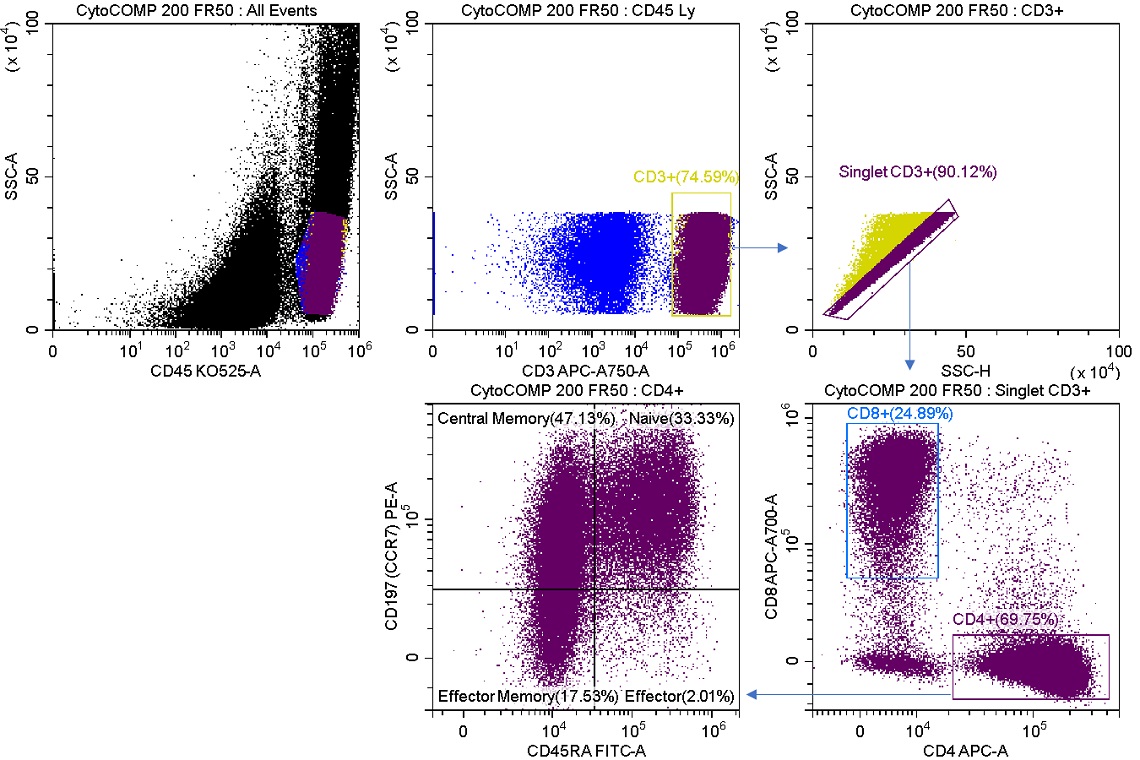
図2. Enrich and Purity ソートする前のサンプル分析結果
再構成した凍結乾燥ヒトリンパ球CYTO-COMP Cell Kit(製品番号6607023)を、使用説明書に従って、DURAClone IM T Cell Subsets(製品番号B53328)で染色し、卓上型セルソーターCytoFLEX SRT でデータを取得しました。領域やゲートは、CytExpert SRT ソフトウエアを使用して描画しました。ソート後の個数と比較するために、全ての領域の個数の統計を表示しています。
卓上型セルソーターCytoFLEX SRTは、CD8+ T細胞をEnrichモードで濃縮するように設定されています(図3, R1)。このサンプルは、形成される液滴の速度と比較して高速で流すことができ、この集団の細胞損失を最小限に抑えることができます。
ソートの効率が高く、アボートによる損失がないことに注目してください。ソートされたサンプルを再分析すると、純度は最初のソート前のサンプルよりも高く、Purifyなどのより厳密なソートモードを使用した場合よりも低くなります(図4)。
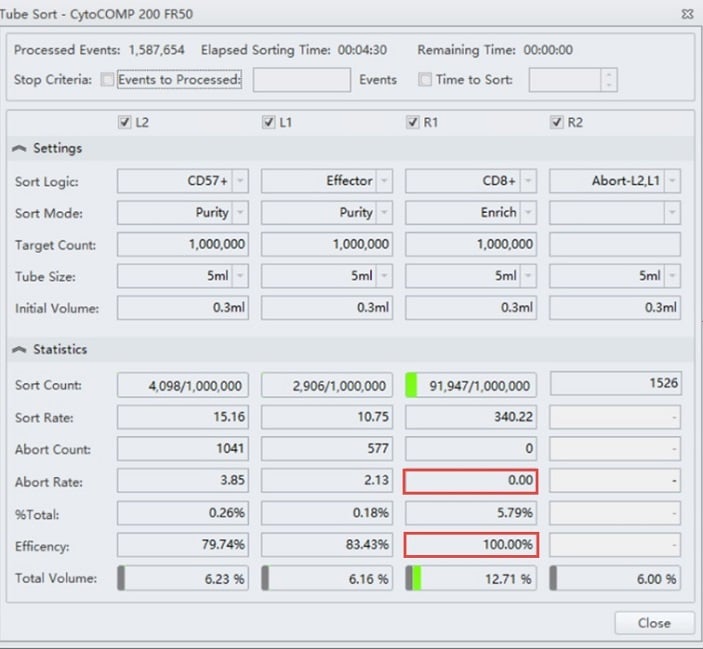
図3. CD8+ 細胞のEnrich モードのTube Sort 設定 4 つのソートストリームの設定
(図2 のサンプルのゲート)を示すTube Sort ウィンドウ例。R1 ポジションはCD8+ 細胞がEnrich モードに設定されています。赤色の四角は、それぞれアボートが0 であり、ソート効率が100%であることを示しています。
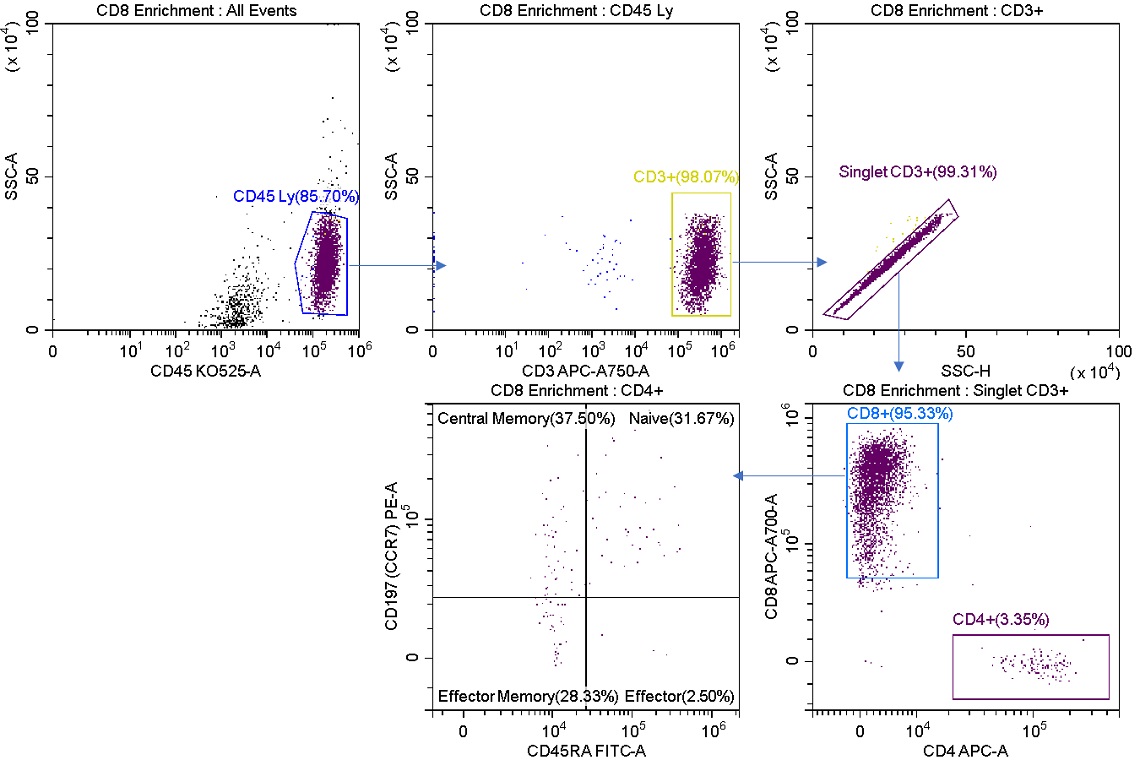
図4. CD8+細胞のEnrichモードソート後の分析
R1ストリームをソート後に分析しました。CD8+ 細胞は、ソーティング前のサンプルの24.89%(図2)に対し、95.33%に濃縮されました。ソートされた細胞にはまだCD4+ 細胞が含まれています。
この実験で、研究者がこの集団を高純度で濃縮することを望む場合は、ソートモードPurityを選択します(図5)。このストリームでは、効率が低いことに注意してください。
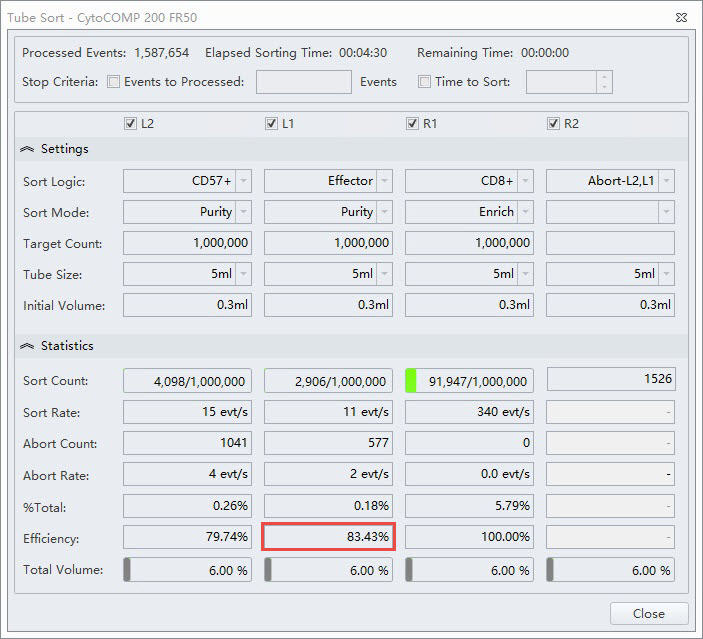
図5.エフェクター細胞のPurityモードのTube Sort設定
4つのソートストリームの設定(図2 のサンプルのゲート)を示すTube Sort ウィンドウ例。L1ポジションはCD4+ エフェクター細胞がPurityモードに設定されています。赤い四角は、Enrichモードと比較してこのソートの効率統計が低いことを示しています。
ソートされたサンプルを再分析すると(図6)、Purifyモードでソートされた集団は、Enrichモードでソートされた集団と比較して非常に高い純度を示しています。ただし、その代償として一部の細胞がアボートによって失われるため、全体的なソートの効率は低下します。純度とアボート率の間のこのトレードオフは、より高速ソートするとき、つまり1秒あたりのイベント数が液滴生成率に近づくにつれて顕著になります。
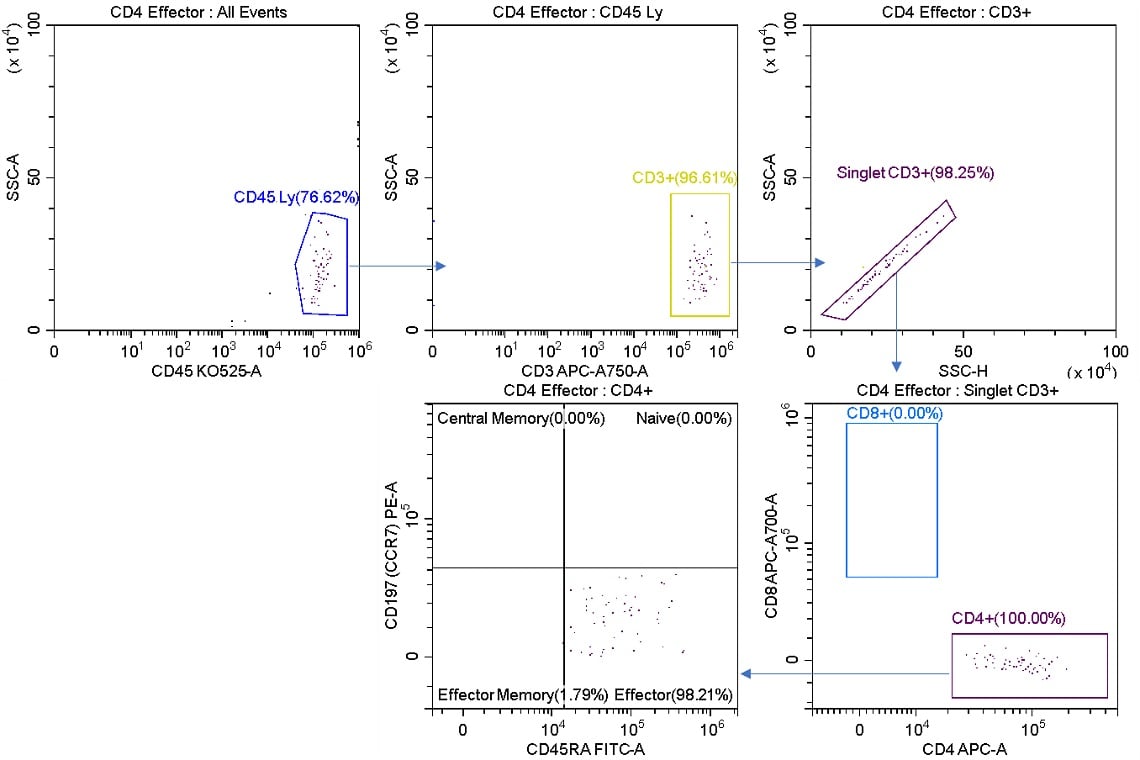
図6. Purifyモードでソートされたエフェクター細胞のソート後の分析
L1ストリームをソート後に分析しました。CD4+ エフェクター細胞はソーティング前のサンプルの2.01%(図2)に対し、98.21%となっています。ソートされた細胞にはCD8+ 細胞は含まれていません。
高速で高純度に集団をソートする
液滴形成の速度と比較して高速でソートすると、効率が低下する(アボートが多くなる)ことを示してきました。このセクションでは、ミックスモードソーティングを利用して、あるストリームで集団を高純度にソートし、そのストリームやほかのソートストリームからのアボートを別のストリームに回収する方法を示します。この方法により、アボートされたイベントを廃棄せず、ほかの実験に利用することができます。
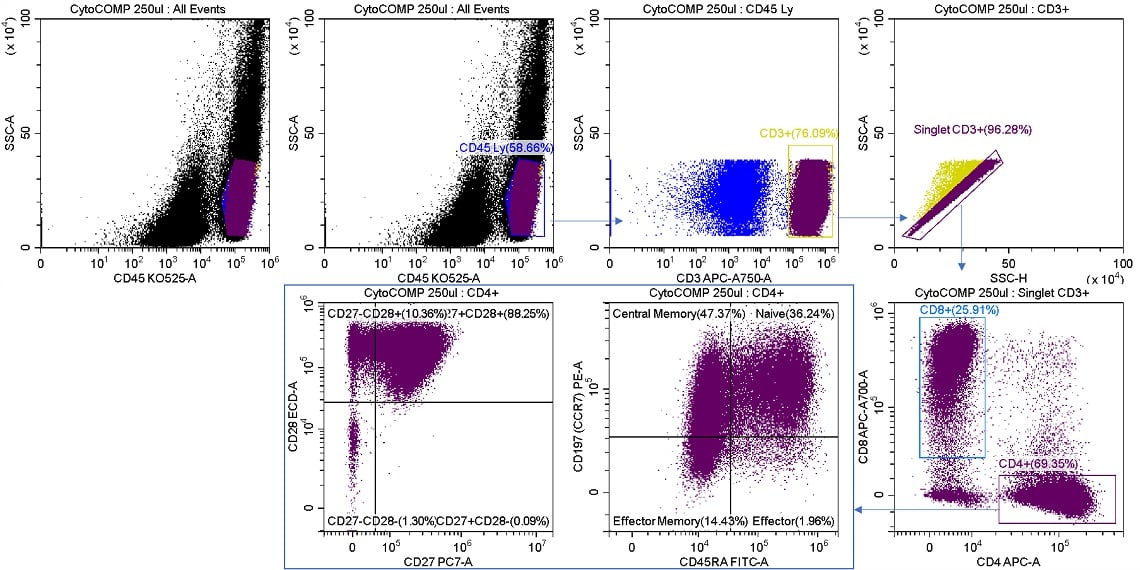
図7. メモリーT細胞のソート前のサンプル分析
凍結乾燥ヒトリンパ球CYTO-COMP Cell Kit (製品番号 6607023)を、使用説明書に従って、DURAClone IM T Cell Subsets(製品番号 B53328)で染色し、セルソーターCytoFLEX SRTでデータを取得しました。リージョンやゲートは、CytExpertSRTソフトウエアを使用して描画しました。ソート後の個数と比較するために、全てのリージョンの統計を表示しています。
以下に示すのは、図7に示したサンプル分析からのCD4+ メモリーT細胞サブセットのソートです。3つのターゲット集団全てにPurityソートモードを使用し、アボートはソートストリームR2に回収します(図8)。
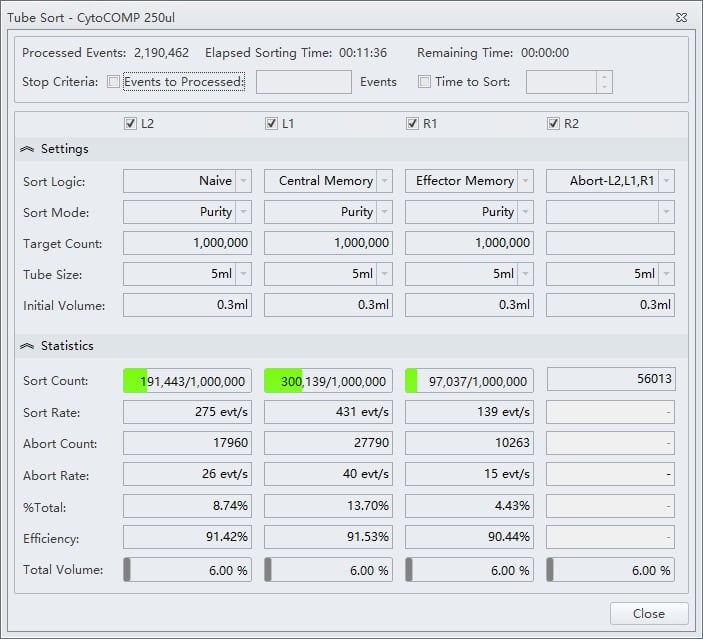
図8. PurityモードとアボートのTube Sort設定
4つのソートストリームの設定(図7 のサンプルのゲート)を示すTube Sort ウィンドウ例。L2、L1、およびR1ポジションはPurityモードに設定され、R2はほかの3つのストリームからのアボートをキャッチするように設定されています。
4つのストリームのうち未使用のストリームがある場合、ほかのストリームのいずれか、または全てからアボートされた液滴を未使用のストリームで回収することができるため、ターゲット集団の損失がないソーティングが可能です。図9は、アボートストリームのソート後の分析結果を示しています。選択された全てのイベントに加えて、アボートの原因となった望ましくないコンタミネーションが表示されています。
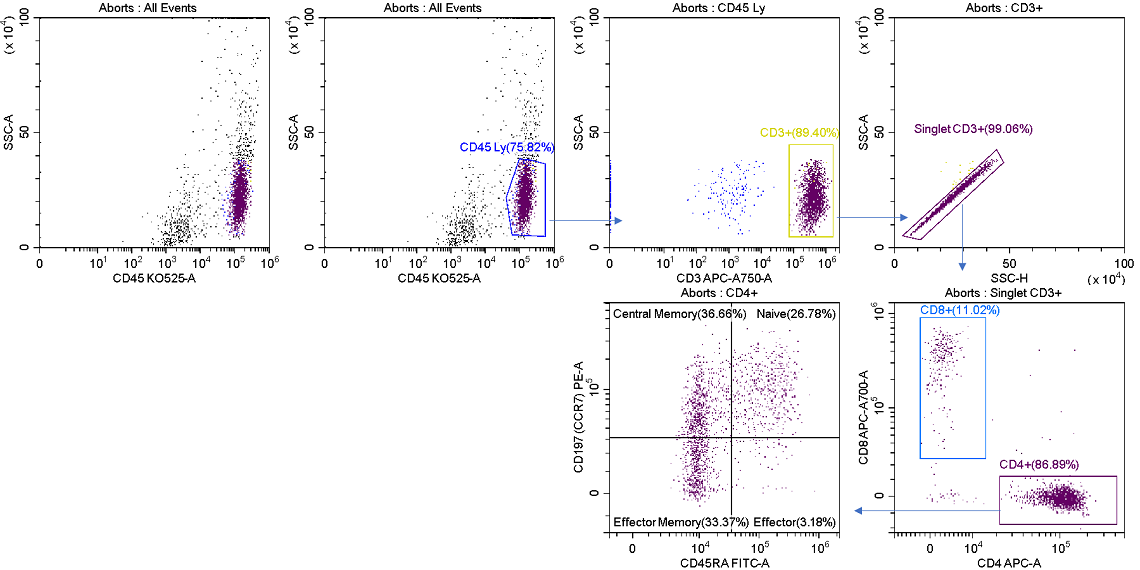
図9. アボートされた細胞のソート後の分析
R2 ストリームをソート後に分析したところ、図7 と比較して、全てのゲート領域でアボートされた液滴に起因するイベントを検出しました。
Key Point
- ソートするときは、速度、収量、純度のバランスを取る必要があります。通常は、これらのうち1つを犠牲にして、ほかの2つに重点を置きます。
- アボートストリームは、多くのアボートの原因であるコンタミネーション集団がある場合、トラブルシューティングに役立ちます。また、アボートストリームを再分析することで、ゲーティング戦略の不備を明らかにすることができます。
- アボートストリームはコンタミネーションが含まれていますが、対象となる集団も含んでいます。このサンプルは、必要に応じてより高い純度で再ソートすることができます。
- アボートストリームは、1つのストリームにまとめることも、個々のアボートストリームに分けることも可能なことを覚えておいてください。
- Enrichモードではアボートはありません。
Summary
CytoFLEX SRTは、ソートモードに複数のオプションを備えているため、研究者はケースバイケースで必要なターゲット細胞の濃縮レベルを高い水準で制御できます。このミックスモードの有用性は、貴重な集団を損失することなくソートすることができることです。集団を高い純度でソートしながら、アボートされたイベントを再ソートしたり、更なる分析のために保存したりすることができます。
For Research Use Only. Not for use in diagnostic procedures.


