卓上型セルソーターCytoFLEX SRTによるシングルセルソーティング
目的
- CytoFLEX SRT用CytExpert SRTソフトウエアでプレートソートを設定する方法を示します。
- 0.5滴と1滴エンベロープ(液滴)の違いを解説します。
Introduction
マルチプレートに細胞を1つずつ分注するシングルセルソーティングには、一般的にセルソーターが用いられています。シングルセルソーティングは、単一の細胞をコロニーに成長させて、クローン細胞株を作成するクローニングによく使われています。また近年、シングルセルゲノミクスやトランスクリプトミクスの進歩から、シングルセルソーティングのニーズが増えてきています。
CytoFLEX SRTのようなセルソーターでは、通常データ分析の結果から得られたプロット図から、ゲートなどを利用して目的の細胞を設定します。設定した目的細胞をチューブにソーティングする場合は、通常何千もの細胞を1つのチューブに集めます。このようなバルクソーティングの場合のソートロジックは、次の実験に必要な純度を達成し、回収率が最大になるように設定します。この場合では、空の液滴や目的ではない細胞(コンタミネーション)がソートされても、結果への全体的な影響は低くなります。このことを知っておくと、より包括的なソートエンベロープやゲーティング戦略の選定に役立ちます。しかしながら、ウェルプレートにシングルセルソーティングする場合は、空の液滴やコンタミネーションの液滴の影響ははるかに大きくなります。各ウェルには、1つ1つの液滴がソートされるため、シングルセルでのゲノム解析を行う場合は、空のウェルやコンタミネーションのウェルがあると結果に大きな影響がでます。よって、シングルセルソーティングの設定を行う際は、プレートへの蓄積効率を考慮する必要があります。つまり、全ての目的細胞を得ることは重要ですが、ある程度の損失を想定する必要があります。しかし、目的の細胞集団が希少であるほど、少々の損失も許容できなくなります。プレートへの蓄積効率が向上すれば、ウェルプレートやチップなどのプラスチック製品を節約したり、試薬などの費用を抑えたりすることができます。
本アプリケーションノートでは、ウェルプレートへのシングルセルソーティングの設定方法を、0.5滴および1滴エンベロープに焦点をあてて説明します。
シングルセルソートの設定
リージョン、ゲート、ソートロジックの作成
全てのソーティングは、まずサンプル分析からスタートします。ここではシンプルなデータのケースで説明します。GFPをトランスフェクションしたHeLa細胞の一部をCytoFLEX SRTで解析しました。
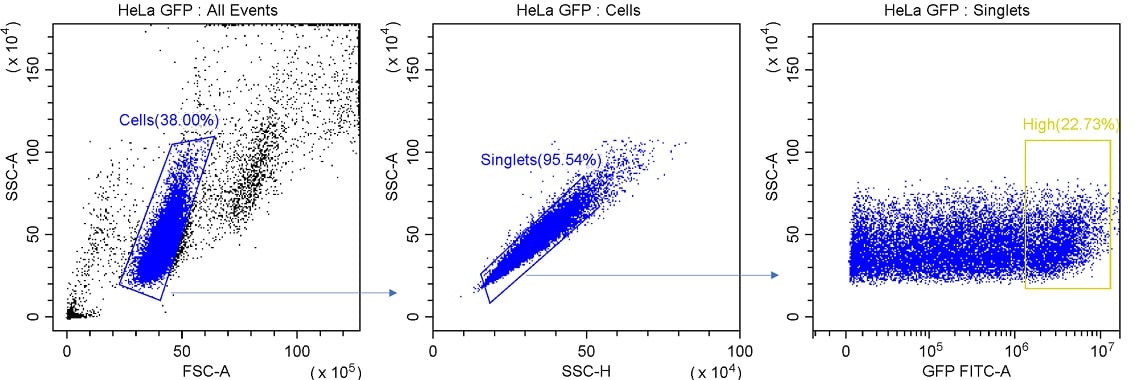
図1. シングルセルソーティングのゲーティング例 細胞は、FSC × SSC プロットでゲートされたリージョンを使用してデブリから分離されます。シングレットイベントは、SSC-H とSSC-A の線形関係によって識別されます。次に、発現レベルに基づいて、望ましいイベントを識別します。
この実験では、3つのプロットと3つのリージョンで目的のイベントを特定することができます。この実験では、GFPを発現している上位20%の細胞が目的のイベントになります。この細胞集団を定義するために、3つのゲートを使用しました。最初に、FSC-AとSSC-Aを比較することで、細胞をデブリから分離します。細胞のタイプによっては、小さな破片や死んだ細胞から細胞を効果的に分離するために、これらのチャネルのゲインを上げる必要があるかもしれません。
全てのソート実験で、ダブレット(互いに接着している細胞)を除くことが重要です。このためにはいくつかの方法がありますが、ここでは、SSC-A(測定されたパルスの面積)対SSC-H(測定されたパルスの高さ)のプロットを使用します。この方法では、シングレットはこれら2つのパラメータの間に非常に密接な関係があります。全てのダブレットは同様の高さのシグナルを持ちますが、2番目の細胞が最初の細胞と近接しているため、面積のシグナルが増加します。このことから、シングレットとダブレットを識別できます。シングルセルソーティング時に、目的細胞に付着した不要な細胞の混入を防いだり、2つの細胞がウェルに入ることを防いだりすることができます。
最後に、この実験では、最もGFPが高発現している細胞のみをソーティングするため、GFP FITC-A軸の高い値を示すイベントにリージョンを設定しました。最終的に、GFPを最も多く発現しているイベントをゲートHighとしました。ゲート統計を用いて、蛍光タンパク質の発現が上位20%の細胞を含むようにリージョンを描画しました。
プレートソートの設定
CytoFLEX SRTでは自動セットアップワークフローにおいて、安定した液滴形成の設定とドロップディレイの測定の作業がセットアップ時に行われます。まず、プレートのキャリブレーションを行った後に、ソートロジックとプレートレイアウトを設定します(詳細は、CytoFLEX SRT IFUの第5章を参照)。
エクスペリメントのTubeから、プレートソーティングのアイコン(図2赤四角)をクリックします(図2参照)。
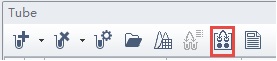
図2. エクスペリメントのTube 内のアイコン エクスペリメントファイルにプレートを追加するために使用されるプレートソーティングアイコンを赤で囲んで示しています。
図3. ブランクプレートのレイアウト ウェルまたは一連のウェルをサンプルウェルとして定義するためのボタンを赤で囲んでいます。
図3にブランクプレートのレイアウトを示します。最初に、どのメディア(プレートタイプ)にソーティングするかを指定します。次に、プレートに入れる方向を、4種類から指定します。左から右に1行ずつ入れていくモード、左から始まり蛇行して1行ずつ入れていくモード、上から下へ1列ずつ入れていくモード、上から始まり蛇行して1列ずつ入れていくモードの4つがあります。
細胞を投入したいウェルを全て選択します。この例では、外側のウェルは空にしています。外側のウェルは長期間の培養ですぐに乾いてしまう可能性があるため、細胞培養実験ではよくこのように行われます。実験のデザインにより、ソーティング位置や数を任意に決めることができます。
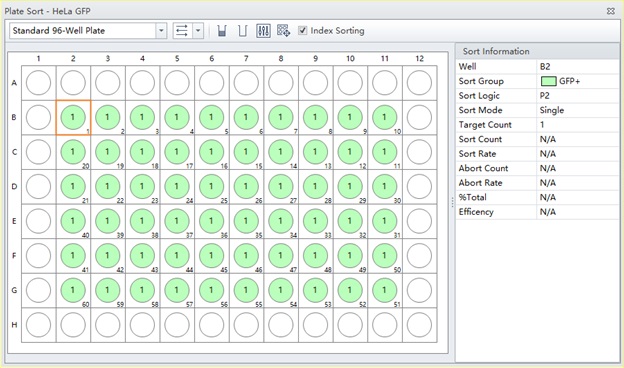
図4. 完成したプレートレイアウト ソートに割り当てられたウェルを緑色で示したプレートレイアウト。
ソートグループに名前を付け(任意)、グループの色を設定します。ここでは、「GFP +」という名前を付け、緑色にしています(図4)。ソートモードにシングルを選択し、目的細胞数1をターゲットカウントに設定します。このように表示されたウェルにソートされる細胞集団を設定します。[OK]をクリックして設定します。
[Start Sort] をクリックすると、プレートのソーティングが始まります。[Duplicate tube without data]を選択し、[Start Sort] をもう一度クリックすると、同じ設定で複数のプレートを実行できます。個々のウェルやウェルのグループを定義することで、追加の集団を空のウェルに振り分けることができます。ただし、ウェルごとに割り当てられるゲートは1つだけです。
ソートエンベロープ
シングルセルアプリケーションでプレートにソーティングする場合、ソートエンベロープのサイズを考慮することが重要です。ソートエンベロープのサイズは、イベントをソートするかアボートするかを決定する際に、液滴内の細胞の位置を考慮します(図5参照)。「Will the event remain in the desired drop, or will it move to the preceding or trailingdroplet?(イベントは目的の液滴に留まりますか、それとも前後の小滴に移動しますか?)」と尋ねられます。
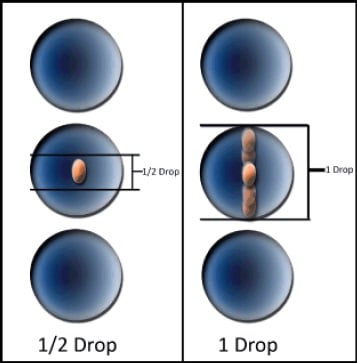
図5. 液滴ソートエンベロープの模式図0.5 滴と1 滴のソートエンベロープのイラスト。細胞のイラストは、各エンベロープ条件でソートされる液滴内の位置を示します。
ソートガードの模式図(図6)には、シングルソートモードで使用される2つのエンベロープの効果が示されています。1滴エンベロープは、目的のイベントが液滴内のどこかにあると予測される限り、その液滴はソートされ、上下の液滴の先行と後続にコンタミネーション細胞がないことを示しています。ただし、このイベントが液滴になる前は、検出用のフローセル内にあり、その後は層流内にあります。液滴間の界面が狭くなり、液滴が割れ始めると、狭くなった空間にある細胞は、流れの中の位置に応じて、後続または先行する液滴に移動する可能性があり、イベントが帯電した液滴から移動した場合には、空の液滴をウェルにソートする可能性があります。目的の細胞が予測された液滴にない場合、空の液滴をソートすると、空のウェルができます。CytoFLEX SRTは、隣接する液滴の端に汚染物質(コンタミネーション細胞)がある細胞をアボートするガードバンドを使用して、この問題に対処します。
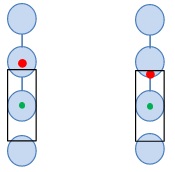
図6. ソートガードバンドの模式図 黒い四角は、汚染物質(コンタミネーション細胞、赤ドット)が存在する可能性が高い場合にアボートされる、先行する液滴と後続する液滴の15%のリージョンを示しています。左側イベントはソートされ、右のイベントはアボートされます。
これに対し、0.5滴エンベロープでは、対象となる細胞が液滴の中央50%にあると予測される液滴のみをソートすることで、この問題に対処します。これにより、空の液滴がウェルにソートされる可能性が低くなります。CytoFELX SRTでシングルソートモードを使用する場合のデフォルトのソートエンベロープは0.5滴です。
プレートソートで、1滴エンベロープを使用すると、2つの結果が生じます。1つめはアボート率が低くなるため、ターゲット細胞の損失を抑えながらプレートをより早く充填できることです。2つめは、いくつかのウェルが空の液滴を受け取るために、全体的なプレート充填効率が低下する可能性があることです。一方、デフォルトの0.5滴エンベロープを使用すると、状況は逆になります。プレートの充填速度は遅くなる場合がありますが、全体的なプレート充填効率は高くなります。プレート効率とプレート充填速度は、細胞のサイズ、ソートのイベントレート、ターゲット細胞の割合などのサンプル特性によっても影響を受けます。
Key Point
- 特に新しいソートメディア出力を追加する場合は、ストリームがターゲットに確実に当たるようにプレートをキャリブレーションすることが重要です。
- プレートを完全に充填することが最も重要な場合は、デフォルトのシングルソートモード0.5滴エンベロープをお勧めします。
- プレートのキャリブレーションの確認に時間はかかりません。キャリブレーションを行うことで液滴がターゲットのウェルに入ることを保証します。
- プレート効率は、PCRによる確認、マルチウェルプレートのイメージング、蛍光顕微鏡での目視確認など、さまざまな方法で測定できます(図7参照)。
- 低容量のマイクロプレートでは、プレートウェルと液滴自体の容量に注意してください。ソートされた細胞が、回収液の外に着地して乾燥してしまうことがあります。また、液滴内のシース液も細胞と一緒にソートされるため、ウェルごとに1つ以上の細胞を少量でソートする場合、全体のボリュームに対するシース液の寄与が問題になる可能性があります。

図7.シングルセルのソート性能 GFPをトランスフェクトしたHeLa細胞をソートモードSingle 0.5でソートし、プレートを蛇行して列全体に充填しました。ソートの回収は、スライドガラス上のメディアの小さなウェルで行いました。細胞を定着させた後、画像を低倍率で撮影して、個々のスポットに存在する単一の細胞を示しました。画像は、3つの異なる実験スライドから得られた33のウェルを表しています。光学顕微鏡の焦点を合わせるために、各実験の1ウェルは10細胞/ウェルとしました(画像は省略)。左列は実験1、中央列は実験2、右列は実験3 。
Summary
CytoFLEX SRTのシングルソートモードは、正確な細胞数でプレート効率が最大化されているという高いレベルの信頼を研究者にもたらします。複数のプレートオプションが最大384ウェルフォーマットで存在し、ストレートダウン(非荷電液滴)ソーティングが可能で、インデックスソーティングデータを収集するオプションもあります。CytoFLEX SRTユーザーは、プレートの充填方法とプレートに配置する集団を柔軟に選択でき、実験システムのニーズに合わせてプレートソーティング条件をカスタマイズできます。
* 研究目的のみで使用できます。診断用には使用できません。