超遠心機および自動分注装置を用いた カーボンナノチューブの調製・精製と 分析用超遠心システムによる解析
要旨
本アプリケーションノートでは、ナノ粒子の精製スケール アップ時の迅速で確実な方法について、また存在する粒子種 の濃度の定量分析、というナノ粒子に関する 2 つの難しい分 野に焦点を当ててご紹介します。 ラボラトリーオートメーションシステムである自動分注装置 Biomek 4000 ワークステーションを使用すれば、オペレー ターによる人為差を抑え、安定的に再現性良く密度勾配を大 量調製することができます。分離用超遠心(Preparative Ultracentrifugation)は安定した超遠心性能により極め て再現性の高い分離手法です。分析用超遠心(Analytical Ultracentrifugation:AUC)は低濃度・少サンプル量で 測定ができ、ナノチューブ、量子ドット、グラフェンといっ たナノ粒子の解析に最適です。また溶液中のナノ粒子の物性 について様々な有用な情報が得られる分析装置です。
序論
単層カーボンナノチューブ(SWCNT)はここ 15 年間、半 導体 1 、燃料電池 2 、および生物医学的応用 3 の面から関心 を集めている素材です。しかしながら、どの分野において も 2 つの大きな課題に直面しています。1 つめは、合成し た SWCNT には、たくさんの炭素質不純物と多層カーボ ンナノチューブ(MWCNT)が混入している可能性がある 点です。加えて、SWCNT 以外のカーボンナノチューブの 比率を定量するための確実な手法が存在しない点です 4 。2 つめは、SWCNT はその炭素原子の並び方 [ カイラリティ
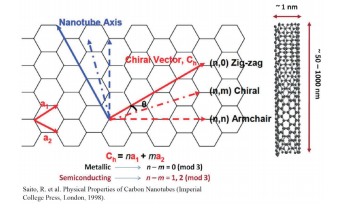
Fig. 1 単層カーボンナノチューブの模式図
(n,m) として知られています ] が異なる様々なものが混合し た状態で合成される点です(Fig. 1)5 。カイラリティが異な る SWCNT は光学的性質および電気的性質が大きく異なりま す 6,7。SWCNT の物性は基本的に基礎となるグラフェンの物 性から導かれるため、カイラル指数と呼ばれる 2 つの整数を 用いて、グラフェン骨格から SWCNT の構造を定義します。 SWNT はカイラル指数(n, m)により決定される幾何構造 により、金属性あるいは半導体性となることが知られています。 n - m = 3 の倍数の場合は金属性 SWNT に、n - m = 3 の 倍数でない場合は半導体性 SWNT となります。このため、 合成後に単一で均一なカイラリティの SWCNT を大量に分離 する手法が求められており、特に半導体(金属性 SWCNT が 混入すると半導体的特性の on/off 比は大幅に低下します 8 ) および in vivo でのドラッグデリバリーおよびイメージングア プリケーション 9-11 においては重要な課題となっています。溶 液中の SWCNT の不純物を測定しようという初期の試みでは 主に電子顕微鏡が利用されましたが、電子顕微鏡では統計的 な有意性は得られず、観察者の主観による影響を受けること があり、直径 3 nm の 2 層カーボンナノチューブ(DWCNT) と直径 1 nm の SWCNT を区別することは困難です。この 不純物問題を解決する手段として、紫外可視吸光分光法、近 赤外蛍光分光法、ラマン分光法が研究されてきましたが、残 念ながらこれらの技術にはそれぞれ固有の欠点があるため SWCNT 不純物を定量的に解析する手法としては十分とは 言えません 4 。
SWCNT の単一のカイラリティ分離に
関して、現在のところ最も有効な手法
の 1 つが密度勾配超遠心分離法です
SWCNT の単一のカイラリティ分離に関して、現在のとこ ろ最も有効な手法の 1 つが密度勾配超遠心分離(Density Gradient Ultracentrifugation;DGU)法です 12,13。 DGU法では純度99%の(6,5) SWCNTを得ることができ、 これは非常に望ましい純度と言えます。しかし、DGU 法で は溶媒のグラージェント作成は従来手作業で行われており、 これがスケールアップ、つまり数十本という多検体を作成す る際の大きな妨げとなっています。
本アプリケーションノートでは、不均一な大量の SWCNT を迅速かつ高い再現性で単一の(6,5)カイラリティに分離し、 紫外可視吸光分光法で確認するワークフローを提案します。 本ワークフローの主な特徴として、3 分間の超遠心分離処理 (Optima MAX-XP)によりサイズの大きい凝集カーボン ナノチューブを取り除き、自動分注装置 Biomek 4000 で 密度勾配を調製後、超遠心機 Optima X シリーズを使用し、 密度勾配超遠心分離法により SWCNT と DWCNT を精製 します。密度勾配調製を自動化することで、手作業に比べて 密度勾配の精度および再現性が向上します。SWCNT の分 離では、スタート時の濃度勾配ステップが± 1% g/mL 程度 しか違わないため、密度勾配用の溶媒調製の精度は重要にな ります。手作業の場合、勾配を乱してしまう可能性がありま すが、自動化した場合その心配はありません。本アプリケー

AUC はナノマテリアル解析において
電子顕微鏡や光学分光分析法では得
られない情報をもたらしてくれます
ションノートの後半では、分析用超遠心システム(AUC)に よって、SWCNT と長さで分離した DWCNT とを定量的に 識別できる方法を示します。これまで AUC は主にタンパク 質の解析に用いられてきましたが、AUC の解析性能はナノ粒 子の特性解析に適しています。AUC は様々な溶媒条件下でナ ノ粒子の沈降係数、拡散係数、摩擦係数を求めることができ るため、AUC はナノマテリアル解析において電子顕微鏡や光 学分光分析法では得られない情報をもたらしてくれます 14,15。
実験手順
密度勾配のためのグラジエント作成
Biomek 4000 により、P-1000SL シングルピペッターツー ルおよび P1000 ワイドボアチップを使用し、密度勾配を作製 しました。柔軟性の高いコントロールソフトウエアを採用して おり、作製したいチューブの本数だけではなく、各勾配の容量 を簡単に設定することができます。遠心チューブ(ベックマン・ コールター、製品番号 331372)は、24 穴チューブラックにセッ トしたものを Biomek のデッキ上に配置しました。勾配作成 時の界面の乱れを最小限に抑えるためにツールの液面検知機能 を使い、非常に遅いスピードで溶液の分注を行いました。今回 は table. 1 に示すような、勾配層を作成しました。
table. 1 単一カイラリティ分離のための密度勾配の構成
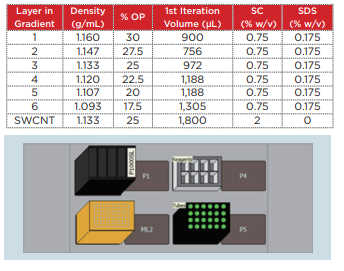
Fig. 2 Biomek 4000 ワークステーションのデッキレイアウト
密 度 勾 配 遠 心 用 溶 液 の 調 製 に 必 要 な ツ ー ル を 示 し ま し た。 (1)24 ポジションチューブラック 1 個配置:遠心管は既存の 24 ポジションチューブラックに配置しソフトウエア上で新規ラブ ウェアを登録。(2)P1000 ワイドボアチップラック 1 個配置。 (3)液体搬送用の P1000SL シングルピペッターツール 1 個配置。 (4)リザーバモジュラー容器に分注元溶液を配置。
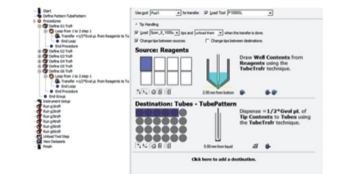
Fig. 3 密度勾配作成のためのメソッド画面
勾配作成時に界面の乱れを防ぐよう新規に分注テクニックを作成。 遠心管への分注は 0.1mm 単位で高さを指定。

Fig. 4 食用色素で色づけしたイオジキサノールによる 勾配調製の確認
マニュアル作製(左)と Biomek 4000 ワークステーションによる 作製(右)を比較しました。勾配の各層がはっきりと確認できました。
単層カーボンナノチューブ(SWCNT)の精製 16
20 mg の SWCNT を、2% コール酸ナトリウム(SC)水溶液(脱 イオン水)の入った 20 mL のガラスバイアル中で、Branson M1800H 超音波洗浄機を用いて 1 時間超音波処理しました。こ の SWCNT 溶液から大きな凝集塊を沈殿して取り除くため、 オープントップ肉厚ポリカーボネート遠心チューブ(ベック マン・コールター、製品番号 362305)に入れて、Optima MAX-XP 卓上型超遠心機で TLA 110 ロータを用いて 22℃、 55,000 rpm(約164,000 xg)で3分間遠心分離を行いました。 ペレットを崩さないように 1,100 µL の上清を注意深く回収し、 密度勾配遠心に使用しました。2% SC+Optiprep (OP)で1.13 g/mL(25%OP)の密度に調整した SWCNT 溶液 1.8 mL を、あらかじめ充填した密度勾配チューブの 27.5% と 25% の Optiprep 層(AXIS-SHIELD 社、国内販売店:コスモバイオ社) の間に注入しました。これらの遠心チューブのバランスを合わ せるため、Optiprep と同じ界面活性濃度の脱イオン水をチュー ブ上端から 2 ~ 3 mm 以内になるまで満たしました。その後、 Optima XPN で SW 41 Ti ロータを用いて、22℃、41,000 rpm(約 288,000 xg)で 32 時間遠心しました。最低の加速 度および減速度を用いて行いました。遠心後、下層を乱さない ように注意しながら、シリンジを用いて最上部 2 mL を除去し ました。(6,5)SWCNT を含む残りの部分は、150 µL ごとの フラクションに分けました(Fig. 5)。
2 層カーボンナノチューブ(DWCNT)の精製
20 mg の DWCNT を、2% コール酸ナトリウム(SC)水溶 液(脱イオン水)の入った 20 mL のガラスバイアルに入れ、 Branson M1800H 超音波洗浄機を用いて 1 時間超音波処理 しました。次に、この DWCNT 溶液から大きな凝集物を沈殿 して取り除くため、オープントップ肉厚ポリカーボネート遠心 チューブ(ベックマン・コールター、製品番号 362305)に入 れて、Optima MAX-XP 超遠心機で TLA 110 ロータを用い て 22℃、27,000 rpm(約 40,000 xg)で 3 分間遠心分離 を行いました。ペレットを崩さないように 1,300 µL の上清を 注意深く回収し、密度勾配遠心に使用しました。DWCNT を長 さの違いで分画するため、table. 2 に示すような密度勾配をポ リアロマー遠心チューブ(ベックマン・コールター、製品番号 331372)中に作製しました。得られた勾配上に先に回収した DWCNT 溶液 1,300 µL を重層しました。これらの遠心チュー ブのバランスを取るため、2% SC 水溶液(脱イオン水)をチュー ブ上端から 2 ~ 3 mm 以内になるまで満たしました。その後、 Optima XPN で SW 41 Ti ロータを用いて、2 ステッププロ グラムにより、まず 22℃で 15,000 rpm(約 38,500 xg)で 1 時間、次に 30,500 rpm(約 159,500 xg)で 1 時間遠心し ました。ロータの加速および減速度は最小で行いました。遠心後、 上から下まで各 600 µL のフラクションを回収し、フラクショ ン 4 ~ 6 を使用しました(Fig. 6)。
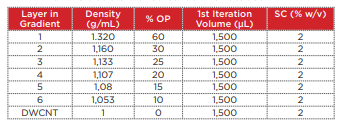
table. 2 2 層カーボンナノチューブ分離用密度勾配の構成
フラクション分析
各 SWCNT の画分について、紫外・可視・近赤外の吸収を確 認するためにモレキュラーデバイス社 Paradigm プレートリー ダーを用いて 400 ~ 1,000 nm の波長範囲を測定しました。 570 nm および 990 nm の吸収ピークが最大で、その他の波 長での吸収ピークが最小であったフラクションを以降の実験で 用いることとしました。
透析
SWCNT:分画後、分離された各 (6,5) カイラリティ SWCNT 分画を、SWCNT 溶液からイオジキサノール(Optiprep)お よびドデシル硫酸ナトリウムを除き、SWCNT を界面活性剤で 再度コーティングするために、1% SC 中でセルロース膜(3.5 kDa MWCO)を用いて透析しました。外液は、4 時間以上 の間隔で 8 回交換しました。透析後、得られた溶液を、小型微 量高速遠心機 Microfuge 20(ベックマン・コールター)で Amicon ウルトラ遠心式フィルター(ミリポア)を用いて濃縮 しました。
DWCNT:同じ手順を用いて、分画した DWCNT 溶液を処理 しました。
沈降測定実験(超遠心分析)
SWCNT および DWCNT 溶液は分析用超遠心システム ProteomeLab XL-A で測定しました。濃縮した (6,5) カイ ラリティ SWCNT サンプルは 570 nm での吸光度が 0.85 あ り、12 mm エポンチャコールフィルダブルセクターセンター ピースおよび石英ウィンドウを持つ測定用セルにサンプルを注 入しました。リファレンス溶液として 1 % SC 水溶液(透析時 の外液)を使用しました。サンプルの容量は 370 µL、リファ レンスの容量は 380 µL としました。2 つ目のセルには長さ で分画した DWCNT サンプル(570 nm、吸光度 0.85)を 注入し、3 つ目のセルには 570 nm で吸収がある SWCNT/ DWCNT(50%/50%) 混合物のものを注入しました。遠心条 件は 22°C、27,000 rpm、4 時間で 17、最初、濃度の依存性 を確認するために 570 nm での吸光度が 0.6 のサンプルを用 いて実験を行いました。
沈降測定解析(超遠心分析)
解析は Lamm の方程式に基づいたモデルフィッティングがで きる解析ソフトウエアである SEDFIT を用いて行いました。 Arnold らの研究にもあるように、Lamm の方程式を用いた解 析は拡散も考慮したうえでの成分評価が可能となります 17。 SWCNTとDWCNTの沈降係数を比較し、分析用超遠心によっ て溶液中の SWCNT と DWCNT が区別可能かについても確認 しました。
動的光散乱法による粒度分布解析
ナノ粒子径測定システム DelsaMax CORE(動的光散乱法お よび静的光散乱法による同時測定システム)(ベックマン・コー ルター)を用いて、長さで分画した DWCNT および (6,5) カ イラリティ SWCNT をそれぞれ解析しました。約 10 µL を石 英キュベットに入れ、25℃で1回5秒の測定を10回行いました。
結果
Fig. 5 から、DGU 法によって SWCNT の分離が容易に行える ことがわかります。超遠心分離の前(Fig. 5a)では、SWCNT は黒い溶液として確認されます。これは、可視範囲にわたり吸 収ピークを持つ様々なカイラリティが混ざり合っているためで す。超遠心分離後には、個々のカイラリティが色つきのバンド(帯 状の縞)として出現しています(Fig. 5b)。トップの紫色のバ ンドは (6,5) SWCNT を含んでおり、AUC 分析用に回収しま した。SWCNT には近赤外および可視領域にファン・ホーブ特 異点があり、SC 溶液中の界面活性剤コーティングされた (6,5) SWCNT は理論上 570 ~ 580 nm および 980 ~ 990 nm にピークが生じます 16。Fig. 7 の吸光度スペクトルは、1% SC 溶液中での (6,5) SWCNT の透析および濃縮後のサンプルを測 定したものです。571 nm と 990 nm に大きなピークがあり、 他の波長では強い吸収が見られないことから、(6,5) カイラリ ティが濃縮された SWCNT の純度を確認できます。DWCNT は、SWCNT と同様の手順で処理した後、長さで分画しました 18。Fig. 6b の最上層のフラクションには、大部分が結束してい ない DWCNT が含まれていると考えられます。動的光散乱法 のデータ(Fig. 8)より、DWCNT は、拡散係数が 2.1 × 10-8 cm2 /s であることから、平均長が約 200 nm であることがわ かります。
DelsaMax CORE で行った動的光散乱法では、単層カーボン ナノチューブと二層カーボンナノチューブを区別することが難 しいこともわかりました(Fig. 8)。DWCNT と SWCNT では、 吸光(Fig. 7)および蛍光などの光学特性は非常に異なってい ますが 19、物理的な直径や密度は非常に似ています。どちらと も長さは 100 ~ 1,000 nm の間にあり、直径も近くなってい ま す(SWCNT は 約 1 nm、DWCNT は 約 2 ~ 3.5 nm19)。 このため、光散乱法のような技術では両者を識別することが 難しくなっています。さらに、電子顕微鏡でも SWCNT と DWCNT を正確に識別するのに必要な高さ方向の分解能を得る ことは困難であり、また 1018 個を超えるナノチューブを含む溶 液において数百個の粒子を計測しても代表値とはなりません。

Fig. 5 カイラリティに基づく (6,5) SWCNT の分離
SWCNT サンプルの密度勾配超遠心分離前(5A)および後(5B) の写真。紫色の部分(矢印)から 0.2 mL を回収し、吸光分析を行い、 575 nm における吸光度ピークを持つことを確認しました。

Fig. 6 DWCNT の長さによる分離
DWCNT サンプルの密度勾配超遠心分離前(6a)および後(6b) の写真。0.6 mL ずつのフラクションに分け、フラクション 4 ~ 6 を解析に使用しました。フラクション 4 ~ 6 のおおよその位置を波 括弧(})で示しています。
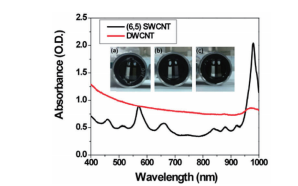
Fig. 7 長さで分画し濃縮した 2 層カーボンナノチューブ(DWCNT、 赤色の曲線)とカイラリティ濃縮した単層カーボンナノ チューブ(SWCNT、黒色の曲線)の吸収プロット
写真は AUC セルのもので、左側のセクターにリファレンス、右側 のセクターにサンプル溶液が入っています。(a)は DWCNT のみ が入っています。(b)は主に (6,5) SWCNT が入っており、これ は 570 および 980 nm の高いピークにより示されています。(c) は DWCNT と SWCNT を 50%/50% で調整した混合溶液が入っ ています。
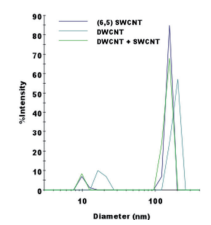
Fig. 8 DelsaMax CORE で得られた代表的な動的光散乱データ
直径 100 nm 超のあたりにはカーボンナノチューブによるピーク があり、直径 10 nm 近くのピークは界面活性剤ミセルのものです。 動的光散乱法では SWCNT と DWCNT を区別することはできませ んでした。
分析用超遠心法では、SWCNT と
DWCNT を簡単に区別することが
できます
分析用超遠心法では、SWCNT と DWCNT を簡単に区別 することができます(Fig. 9)。DWCNT は、コール酸ナ トリウムによる界面活性剤でコーティングされにくいため、 SC 緩衝液中では超遠心分離中に非常に速く沈降し、沈降 係数は 80.4 ± 25.6 S を示しました(Fig. 9b、10b)。 対照的に、SWCNT は、過去に文献で報告されているよ うに 17,20、ゆっくりと沈降し、沈降係数は 11.3 S を示しま した(Fig. 9a、10a)。AUC の分解能力を確認するため に、SWCNT と DWCNT の混合溶液を作製しそれぞれが 分離できるかを試しました。570 nm で吸光度 0.894 の SWCNT 溶液と DWCNT 溶液を、各 175 µL ずつを混合し、 AUC で分析しました(Fig. 9c)。(6,5)SWCNT のみの場 合は、沈降係数が 5 ~ 30 S であるのに対し(Fig. 10a)、 長さで分画した DWCNT の沈降係数は 30 ~ 140 S でし た(Fig. 10b)。このため 30 S をカットオフ値として沈降 係数分布プロット(Fig. 10c)から、この 50%/50% で混 合した溶液には 50.4% の SWCNT と 49.6% の DWCNT が含まれていることが定量的に示されました。SWCNT お よび DWCNT をこのように定量評価することが可能な分 析技術は他にはありません。AUC の定量能力を確認する ために、別の 2 種類の SWCNT と DWCNT の混合溶液 を試しました。吸光度で 29% SWCNT/71% DWCNT の 溶液は、沈降係数分布より 28.3%/71.7% の割合であるこ とがわかりました(Fig. 10d)。同様に、吸光度で 71.4% SWCNT/28.6% DWCNT の溶液は、沈降係数分布より 64.7%/35.3% の割合であることがわかりました(データ 未掲載)。
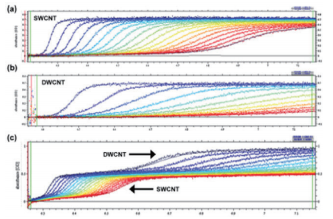
Fig. 9 SEDFIT による AUC 測定データの解析
(9a)(6,5) SWCNT の生データとフィッティング結果です。(9b) 長さで分画した DWCNT の生データとフィッティング結果です。 (9c)(6,5) SWCNT と DWCNT の混合溶液の生データとフィッ ティング結果です。
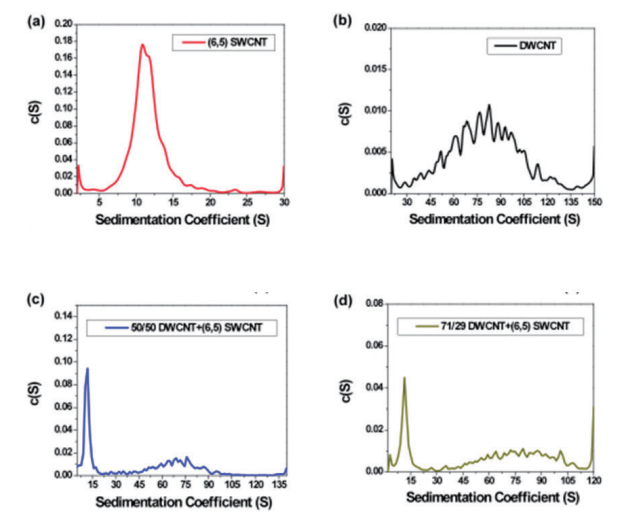
Fig. 10 沈降係数分布プロット
(10a) (6,5) カイラリティSWCNT: (6,5) カイラリティSWCNTの沈降係数は11.3 Sで、文献値とよく一致しています。基本的に、(6,5) SWCNT 溶液に含まれる粒子の沈降係数は 30 S 未満でした。
(10b)長さで分画した DWCNT:長さで分画した DWCNT の沈降係数は 80.4 ± 25.6 S でした。大きく広がっていることより一部の DWCNT はバンドルしている可能性が考えられます。DWCNT サンプル中のほぼすべての沈降した粒子の沈降係数は 30 S 以上 でした。
(10c)DWCNT および (6,5)SWCNT の 50/50 混合溶液:DWCNT 溶液と (6,5)SWCNT 溶液を、570 nm の吸光度が等しいもの を等量で混合しました。沈降係数分布より、全体のうちの 50.4% は沈降係数が 5 ~ 30 S の間にあり平均値が 11.2 ± 5.2 S であり、 49.6% は沈降係数が 30 ~ 140 S の間にあり平均値が 70.2 ± 21.3 S でした。
(10d) DWCNT および (6,5)SWCNT の 71/29 混合溶液:DWCNT 溶液と(6,5)SWCNT 溶液は、570 nm の吸光度が等しい、 DWCNT:(6,5)SWCNT を 71:29 の割合で混合しました。沈降係数分布より、全体のうちの 28.3% は、沈降係数が 2 ~ 30 S の間にあり平均値が 12.5 ± 3.9 S であり、71.7% は、沈降係数が 30 ~ 120 S の間にあり平均値が 80.0 ± 21.0 S でした。
References
1. Baughman R H, Zakhidov A A, and de Heer W A. Carbon nanotubes̶the route toward applications. Science. 297.5582; 787–792: (2002).
2. Che G et al. Carbon nanotubule membranes for electrochemical energy storage and production. Nature. 393.6683; 346–349: (1998).
3. Liu Z et al. Carbon nanotubes in biology and medicine: in vitro and in vivo detection, imaging and drug delivery. Nano research. 2.2; 85–120: (2009).
4. Lopez-Lorente A I, Simonet B M and Valcarcel M. Qualitative detection and quantitative determination of single-walled carbon nanotubes in mixtures of carbon nanotubes with a portable Raman spectrometer. Analyst. 138.8; 2378–2385: (2013).
5. Saito R. Physical properties of carbon nanotubes: (1998).
6. O’Connell M J et al. Band gap fluorescence from individual single-walled carbon nanotubes. Science. 297.5581; 593–596: (2002).
7. Liu H et al. Large-scale single-chirality separation of single-wall carbon nanotubes by simple gel chromatography. Nature Communications. 2; 309: (2011).
8. Zhang L et al. Assessment of chemically separated carbon nanotubes for nanoelectronics. Journal of the American Chemical Society. 130.8; 2686–2691: (2008).
9. Welsher K et al. A route to brightly fluorescent carbon nanotubes for near-infrared imaging in mice. Nature nanotechnology. 4.11; 773–780: (2009).
10. Liu Z et al. Supramolecular stacking of doxorubicin on carbon nanotubes for in vivo cancer therapy. Angewandte Chemie International Edition. 48.41; 7668–7672: (2009).
11. Bhirde A A et al. Targeted killing of cancer cells in vivo and in vitro with EGFdirected carbon nanotube-based drug delivery. ACS nano. 3.2; 307– 316: (2009).
12. Green A A, Duch M C and Hersam M C. Isolation of single-walled carbon nanotube enantiomers by density differentiation. Nano Research. 2.1; 69–77: (2009).
13. Komatsu N and Wang F. A comprehensive review on separation methods and techniques for singlewalled carbon nanotubes. Materials. 3.7; 3818–3844: (2010).
14. Carney R P et al. Determination of nanoparticle size distribution together with density or molecular weight by 2D analytical ultracentrifugation. Nature Communications. 2; 335: (2011).
15. Falabella J B et al. Characterization of gold nanoparticles modified with single-stranded DNA using analytical ultracentrifugation and dynamic light scattering. Langmuir. 26.15; 12740–12747: (2010).
16. Antaris A L et al. Ultra-Low Doses of Chirality Sorted (6, 5) Carbon Nanotubes for Simultaneous Tumor Imaging and Photothermal Therapy. ACS nano. 7.4; 3644–3652: (2013).
17. Arnold M S et al. Hydrodynamic characterization of surfactant encapsulated carbon nanotubes using an analytical ultracentrifuge. ACS nano. 2.11; 2291– 2300: (2008).
18. Tabakman S M et al. Optical properties of singlewalled carbon nanotubes separated in a density gradient: length, bundling, and aromatic stacking effects. The Journal of Physical Chemistry C. 114.46; 19569–19575: (2010).
19. Hertel T et al. Spectroscopy of single-and doublewall carbon nanotubes in different environments. Nano letters. 5.3; 511–514: (2005).
20. Fagan J A et al. Analyzing Surfactant Structures on Length and Chirality Resolved (6, 5) Single-Wall Carbon Nanotubes by Analytical Ultracentrifugation. ACS nano. 7.4; 3373–3387: (2013).

