Allergenicityキットによる活性化好塩基球の検出
従来のヒスタミンリリーステストHRTや、アレルゲン特異的抗体を検出するRASTとは異なり、Allergenicityキットは、エフェクター細胞の一つである好塩基球の細胞機能を指標とする新たなアレルギー・細胞機能試験用の研究用試薬キットです。好塩基球(CRTH2+/CD203c+/CD3-)を正確にゲーティングし、CD203cの発現強度からアレルゲンなどの刺激に対する好塩基球活性化を測定します。花粉症や食物アレルギー、減感作療法などの研究で有用性が示唆されています。
全血検体(抗凝固剤はヘパリン以外にEDTAも使用可能)に活性化バッファと、アレルゲンまたは活性化ポジティブコントロール試薬を添加して好塩基球を活性化し、同時に3カラー蛍光標識抗体(CRTH2-FITC/CD203c-PE/CD3-PC7)で染色します。染色後は、赤血球を溶血除去してフローサイトメーターで測定します。測定には、FS、SSおよびFITC蛍光、PE蛍光、PC7(PE-Cy7)濃赤色蛍光が検出可能な3カラーフローサイトメーターが必要です。
はじめに
Allergenicity キットは、フローサイトメトリーによって末梢血好塩基球の各種アレルゲンに対する反応性を検出するための試薬キットです。好塩基球に特異的な細胞表面マーカーであるCD203c の発現強度が、細胞の活性化に伴って増強することを利用して活性化好塩基球を検出することが可能です。
通常、好塩基球は細胞表面にFc レセプタを介してアレルゲン特異的IgE 抗体を結合しており、アレルゲンによって細胞表面のIgE 抗体が架橋されると細胞の活性化が起こります。活性化した好塩基球は最終的には脱顆粒し、ヒスタミンなどのアレルギー症状を惹起する化学物質を放出します。花粉症に代表されるⅠ型アレルギーでは、これまで肥満細胞がもっとも重要なエフェクター細胞であるとされてきましたが、最近は好塩基球の役割も注目されています1)。さらに、組織に存在する肥満細胞は臨床において活性を測定することが困難ですが、末梢血中の好塩基球を利用すれば、エフェクター細胞を直接、かつ簡便に評価することが可能になります。
好塩基球のアレルゲンに対する反応性に着目した試験方法には、ヒスタミンリリーステスト(HRT)がありますが、これは好塩基球が脱顆粒した際に放出されるヒスタミンを定量するものです。したがって好塩基球の活性化を検出しているとは言えず、必ずしも十分な感度を有していない場合も少なくありません。一方、最も汎用されているアレルギーの臨床検査法としてRAST(Radioallergosorbent Test)があります。これは、末梢血中のアレルゲン特異IgE 抗体を検出することによって、感作アレルゲンを同定するin vitro 試験として非常に有用です。しかしながら、測定対象は末梢血中に遊離しているIgE 抗体であり、生体や細胞のアレルゲンに対する反応性を直接反映するものではありません。
Allergenicity キットは末梢血好塩基球の活性化をフローサイトメトリーにより直接、高感度に検出するため、食物アレルギーの診断、特に耐性獲得の診断や、減感作療法の効果判定及びモニタリングなどに応用可能と考えられます2)。
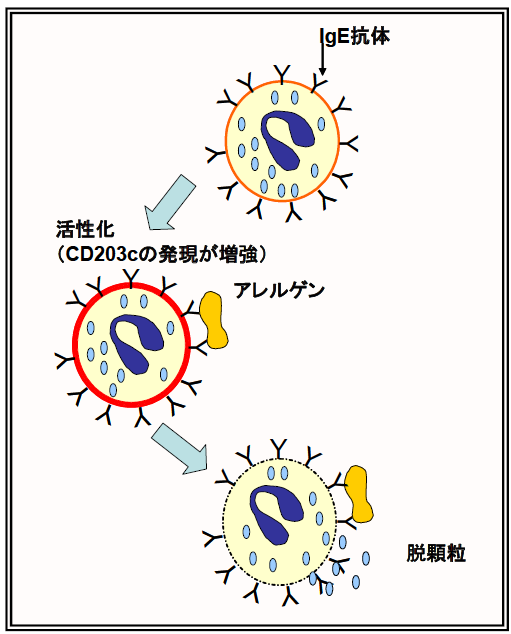
<図1.末梢血好塩基球の活性化及び脱顆粒>
アレルゲンによる細胞表面のIgE 抗体の架橋によって活性化し、最終的に脱顆粒してアレルギー症状を誘発。組織中の肥満細胞も同様の反応によって脱顆粒することから、より採取の容易な好塩基球による試験が有用であると考えられる。
Allergenicity キットの好塩基球検出方法(ゲーティングストラテジー)
好塩基球は末梢血中にはごく少数しか存在せず、その散乱光特性(スキャッターサイトグラム上の位置)がリンパ球 や単球に近いため、CD203c-PE のみを用いたシングルカラー測定では好塩基球集団の判別が難しい場合が少なく ありません(図2)。

<図2.CD203c による非活性化状態の好塩基球測定例>
(健常者末梢血)
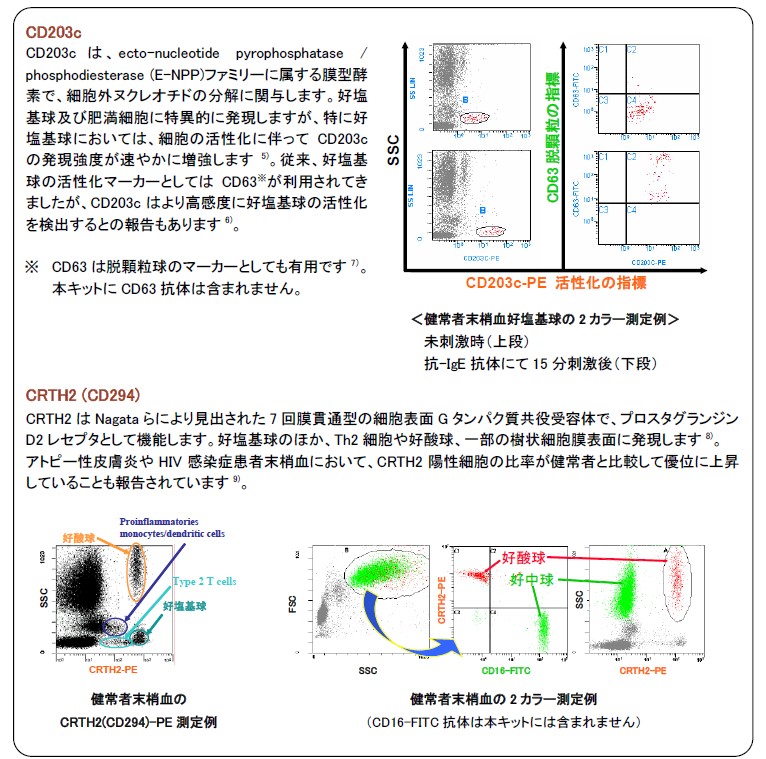
Allergenicity キットは好塩基球の特異的なマーカーであるCD203cに、リンパ球の大部分を占めるT リンパ球のマーカーであるCD3 と、好塩基球、Th2 リンパ球及び好酸球に特異的に発現するCRTH2(CD294)を組み合わせることで、好塩基球のより確実なゲーティングを可能にしています(図3)。3,4)

<図3. Allergenicity キットによる末梢血好塩基球の3 カラー測定例>
(雑草花粉エキスにて刺激)
- 全白血球にゲートを設定 → CD3-PC7/SSC プロットに展開
- CD3 陰性の単核球領域にゲートを設定 → CRTH2(CD294)-FITC/SSC プロットに展開
(CRTH2 陽性細胞のうち、顆粒球領域に存在する好酸球、CD3 陽性であるTh2 細胞は除外され、CD3 陰性単核球ゲートのCRTH2 陽性細胞は好塩基球のみとなります。)
*CRTH2 陽性細胞については次ページを参照 - CRTH2(CD294)、CD203c ダブルポジティブの細胞集団が好塩基球
(活性化に伴いCD203c 蛍光強度が増強します) - 好塩基球をヒストグラムに展開(横軸:CD203c-PE)
Allergenicity キット(製品番号:A17116) 試薬構成
| CRTH2(CD294)-FITC/CD203c-PE/CD3-PC7 3 カラー抗体 | 100 テスト×1 バイアル |
| ポジティブコントロール試薬(抗-IgE 抗体:凍結乾燥品) | 100 テスト×1 バイアル |
| 活性化バッファ | 50 テスト×2 バイアル |
| 反応停止液 | 100 テスト×1 バイアル |
| 溶血試薬 | 50 テスト×3 バイアル |
| 固定試薬 | 100 テスト×1 バイアル |
| 容量:100 サンプル分 | 1キットで測定サンプル100 本分の調製が可能です。ネガティブコントロール及びポジティブコントロールの立て方によって、測定可能な検体数は変動します。 |
キット内に機器調整(感度設定、蛍光補正)用の試薬及び刺激に使用するアレルゲン試薬は含まれませんので、別途ご用意ください。また、アレルゲン試薬については、弊社での取り扱いはございません。あらかじめご了承ください。
機器調整
Allergenicity キットは、CRTH2(CD294)-FITC/CD203c-PE/CD3-PC7 による3 カラー解析を行います。測定に際しては、事前に適切な光学フィルタを設定し、感度及び蛍光補正を最適化しておく必要があります。
- 重要 光学フィルタ設定
FITC、PE 及びPC7 の波長特性は下記のとおりです。必要に応じて、光学フィルタ設定を変更してください。
Cytomics FC500 サイトメーターをご使用の場合、光学フィルタ設定の変更は必要ありません。


注意
EPICS XL をご使用の場合は、光学フィルタ設定の変更が必要です。光学フィルタ設定の変更には、お手持ちの光学フィルタまたは下記フィルタキットをご利用ください。

上記以外のフローサイトメーターをご使用の場合は、機器メーカーにお問い合わせください。
ネガティブコントロール及び適当な抗体を利用して、FL1(FITC 蛍光を検出)、FL2(PE 蛍光を検出)及びFL5(PC7蛍光を検出 ただしEPICS XL の場合はFL4)検出器の感度と各検出器間の蛍光補正を調整してください。蛍光補正は、必ずしもサンプル測定に使用するのと同じ抗体で染色して調整する必要はありません。例えばCD3-FITC、CD8-PE 及びCD4-PC7 の各単染色サンプルを使用して調整することも可能です。
蛍光補正は以下の6 通りの調整が必要です(計3 つのプロット(2 パラメータ)が必要になります)。

※ EPICS XL の場合、PC7 蛍光はFL4 で検出(ただし光学フィルタの交換が必要)
なお、感度調整及び蛍光補正に必要な試薬はAllergenicity キットには含まれません。別途ご用意ください。
機器調整の操作方法詳細は、機器取り扱い説明書をご参照ください。
蛍光補正や測定原理の詳細については、下記弊社サイトメトリー専門Web サイトにおいても解説しています。
ベックマン・コールター株式会社 サイトメトリー専門Web サイト: http://www.bc-cytometry.com/
サンプル調製手順
下表及び Allergenicity キット製品能書を参照して、測定サンプルを調製してください。好塩基球のCD203c 発現強度は検体によって異なりますので、ネガティブコントロール(非活性化好塩基球)は検体ごとに調製されることをお勧めします。また、ポジティブコントロール(活性化好塩基球)に関しても、当該検体の好塩基球が細胞表面のIgE 抗体に対する刺激に対して十分な反応性を有しているかを確認するために、検体ごとに測定されることをお勧めします。
なお、アレルゲンエキスはキット内に含まれませんので、別途ご用意ください。
また、初回アッセイ時には、数段階の希釈系列を作成したアレルゲンエキスを利用して、最適なアレルゲンエキス濃度を決定する必要があります。

※1: ポジティブコントロール(抗-IgE 抗体)は凍結乾燥品です。1mL の精製水に溶解してください。
溶解後の抗体は、少量ずつ小分けして-20℃にて凍結保存してください。
アッセイ時には、融解後20 倍希釈した溶液をワーキングソリューションとして使用します。
※2: 検体としてヘパリン血を用いる場合には、活性化バッファの添加は必要ありません。
※3: キット添付の溶血剤及び固定試薬を用いて、あらかじめ調整が必要。 溶血試薬:固定液=40:1
※4: キット添付の固定液とPBS 溶液による調整が必要。 固定液:PBS=1:80
サンプル測定
本キットは、3 カラー(FITC/PE/PC7)アプリケーションです。下記例を参考にプロットを設定したのちに感度設定及び蛍光補正を行い(プロトコル作成)、前頁の手順で調整したサンプルを測定してください。
下図の中段及び下段プロットは感度及び蛍光補正の調整用プロットです(下段の1 パラメータヒストグラムで感度設定、中段の2 パラメータドットプロットで蛍光補正)。ここではリンパ球を利用して調整する場合を想定して、調整用のプロットにはリンパ球ゲート(左上プロット内のLymph リージョン)を設定しています。

EPICS XL を使用する場合は、PC7 蛍光の検出に選択する検出器はFL4 になります(ただし光学フィルタの交換が必要)。
図ではFL5 を選択(FC500 で測定の場合)

測定に際してのヒント
- 好塩基球は、全白血球中の1%程度と極めて微量な細胞です。測定の際には、全白血球で100,000 イベント程度のデータを取得することをお勧めします。好塩基球分画として500 イベント以上のデータを得る場合には、さらに総イベント数を多くしなければいけない場合もあります。
- テストサンプルにおける好塩基球の活性化程度は、アレルゲンエキスの代わりにPBS を添加したネガティブコントロールとの比較により判定します。ネガティブコントロールは、検体ごとに必ず測定してください。
- ポジティブコントロールは、抗-IgE 抗体によって好塩基球表面に結合したIgE 抗体を架橋することでCD203cの発現を増強させます。もし、ポジティブコントロールとネガティブコントロールのCD203c 発現強度に差が認められない場合には、再度サンプルを調製し直してから測定してください。また、好塩基球自体が確認できない場合などは、機器設定(感度設定及び蛍光補正)も見直すことをお勧めします。
- まれに、抗-IgE 抗体によっても反応しないNon-responder が存在しますが、IL-3 とのプレインキュベーションにより反応性が回復する場合があります。
データ例
スギ花粉症測定例
(データ提供:(独)国立病院機構 三重病院 臨床研究部 藤澤隆夫先生)
EDTA 採血したスギ花粉症(スギRAST:クラス4,総IgE 値:130U/mL)全血に、治療用標準化スギ花粉エキスを添加して好塩基球の活性化を検出(CRTH2-FITC/CD203c-PE のドットプロット上にて、活性化好塩基球を赤でペイント)。添加したスギアレルゲン量の上昇に伴って、好塩基球表面のCD203c 発現強度(蛍光強度)も上昇していることが分かります。
ヒストグラム中の陽性率(%)は、全好塩基球に対する活性化好塩基球の割合。

テストサンプル(スギアレルゲンエキスにて刺激)

測定及びデータ解析: (独)国立病院機構 三重病院 臨床研究部
長尾みづほ先生、徳田玲子先生、野間雪子先生
参考文献
- Falcone FH, Haas H, Gibbs BF : The human basophil: a new appreciation of its role in immune responses.Blood 2000, 96(13) : 4028-38.
- Hida S, Tadachi M, Saito T, Taki S : Negative control of basophil expansion by IRF-2 critical for the regulation of Th1/Th2 balance. Blood 2005, 106(6) : 2011-7.
- Bouvier G, Dehard AL, Gendt L, Canino C, Bienvenu J, Monneret G : A new three-colour flow cytometric combination (CD203C/CRTH2/CD3) for monitoring allergen-induced basophil activation. Cytometry 2004, 59A(1) : 134.
- Radhia B, Anne-Lise D, Guillaume M : The basophil activation test by flow cytometry: recent developments in clinical studies, standardization and emerging perspectives. Clin. Mol. Allergy 2005, 3 : 9.
- Buhring HJ, Seiffert M, Giesert C, Marxer A, Kanz L, Valent P, Sano K : The basophil activation marker defined by antibody 97A6 is identical to the ectonucleotide pyrophosphatase/phosphodiesterase 3. Blood 2001, 97(10) : 3303-5.
- Boumiza R, Monneret G, Forissier MF, Savoye J, Gutowski MC, Powell WS, Bienvenu J : Marked improvement of the basophil activation test by detecting CD203c instead of CD63.
Clin. Exp. Allergy 2003, 33(2) : 259-65. Comment in:
Clin. Exp. Allergy 2003 Jun; 33(6) : 849-2; author reply 852-3.
Clin. Exp. Allergy 2003 Jun; 33(6) : 849; author reply 852-3. - Knol EF, Mul FP, Jansen H, Calafat J, Roos D : Monitoring human basophil activation via CD63 monoclonal antibody 435. J. Allergy Clin. Immunol. 1991, 88(3 Pt 1) : 328-38.
- Nagata K, Tanaka K, Ogawa K, Kemmotsu K, Imai T, Yoshie O, Abe H, Tada K, Nakamura M, Sugamura K, Takano S : Selective expression of a novel surface molecule by human Th2 cells in vivo. J. Immunol. 1999, 162(3) : 1278-86.
- Cosmi L, Annunziato F, Galli MIG, Maggi RME, Nagata K, Romagnani S : CRTH2 is the most reliable marker for the detection of circulating human type 2 Th and type 2 T cytotoxic cells in health and disease. Eur. J. Immunol. 2000, 30(10) : 2972-9.

