超遠心法を用いたエクソソームの分離精製
|
|
九州大学大学院薬学研究院 革新的バイオ医薬創成学講座 |
エクソソームの精製及び解析は近年急速に進んでおり、エクソソーム関連の論文の70%以上はここ6年以内の論文です。エクソソームは、ほとんどすべての細胞種から放出される膜小胞(直径約30~120nm)で、血漿や他の体液から簡便に入手でき、タンパク質、mRNA、およびmiRNAを含んでいます。そのため、エクソソームは治療用バイオマーカーとしてだけでなく、診断用バイオマーカーとしても注目されています。また、エクソソームは細胞間の情報伝達機能の一部であるとみられているため、エクソソームの分類に関しての研究分野は近年非常に注目を集めています。しかし、確立した分離精製プロトコールが存在しないことから、条件の異なる方法で精製されたエクソソームのデータが蓄積されているのが現状です。同じ条件で精製されたデータを蓄積し、比較することが望まれています。
そこで今回は、九州大学大学院薬学研究院 革新的バイオ医薬創成学講座原田結助教と松田大介先生に、エクソソームの分離精製手法につきまして寄稿していただきました。
エクソソームの分離精製手法
私たちの研究室では、虚血肢における血管新生について、マウス下肢虚血モデルを用いた研究を行っています。その中で、これまでほとんど報告の無いエクソソーム中のmicroRNAについて解析を進めています。
エクソソームは遊走性を持ち、特定の細胞への情報伝達を担い、その種類は多岐に渡ると考えられています。例えば、内包するタンパク質や核酸の組成、膜の表面抗原、大きさや密度が異なっているものが知られています。このように豊富なバリエーションが存在するため、分類に関して多くの研究が行われ論文が発表されています。一方で、その分離/精製方法も多岐に渡り、それぞれに一長一短あることから、画一的なプロトコールに従って精製されたエクソソームに関するデータ蓄積が出来ていないのが現状と考えています。これまでに最も多く用いられてきた手法は超遠心法であり、後述のような各種条件を勘案すると、実験内容にも依りますが現状では最善の選択肢であろうと考えています。
エクソソームの精製は超遠心法のほかに、CD63やCD81などを膜表面に保有していることを利用した抗体・磁気ビーズなどによる精製法や、エクソソームを特異的に得ることが出来ると言われている各種試薬法が知られています。それぞれは分離/精製のアプローチが異なり、粒子サイズ、 表面抗原、析出のし易さなどを利用しています。
超遠心法は、理論的に偏りの無い回収が可能で、且つ成分非公開の分離用試薬を含まない状態で回収出来る点で優れていると考えられます。
抗体・磁気ビーズ法は大型機器を必要としない簡便な方法ですが、特定の抗原のみを利用しているため、その抗原を持たないものは原理的に分離することが出来ません。現状では精製段階でセレクションがかかるので、それを前提に解析を進めなければなりません。例えば抗CD63抗体をターゲットとした場合、CD63を持たないエクソソームは分離されない一方で、CD63を持つ血小板・膜小胞体はすべて分離されますので、不純物が多くなる場合があります。動的光散乱法で粒径解析すると、エクソソームとは異なるより大きな位置にピークが立つことで確認出来ます。但しこれは、エクソソームが特定の表面抗原を特異的に持つことが立証されれば、これ以上ない精度で分離が可能になるかもしれません。実際、血球系分離キットなどはこのようにして精度を向上させてきました。
一方試薬法は、試薬をサンプルに混ぜて1,500 xg程度の遠心力で15分間ほど遠心するだけでエクソソームが分離されるという方法です。原理としてはサンプル内にある巨大分子の溶解度を下げることで析出させるというものです。しかし、これら試薬の成分は一般に非公開であり、最終産物は他の方法と比較して明らかに大きなペレットを形成することから、収量が多いのに加えてエクソソーム以外の成分(試薬由来含む)がペレットに含まれていることが考えられます。実際に試薬のみを分析した結果、エクソソームよりも小さい微小な粒子の存在が認められました。このため、製品によっては試薬による精製後に磁気ビーズなどの抗体法によって精製することを推奨しているものもあります。従って、回収したエクソソームを細胞や動物に作用させる系を構築する場合にはどうしても二次精製が必要になりますので、結果として手間も掛かる上に回収効率も下がることになってしまいます。
超遠心法は言ってしまえば昔ながらの力技ですが、一番確実とも言えます。前述の細胞分離の系でも言えることですが、例えば末梢血から全白血球を回収しようと思えば、フィルターやビーズなどを使わずに、遠心するのが確実です。超遠心法での精製プロトコールは Fig.1の通りです。得られたペレットを動的光散乱により解析すると直径100nm付近にエクソソームのピークが得られます( Fig.2)。この方法は他の方法と比較して、理論的に偏りの無い回収が可能で、且つ成分非公開の分離用試薬を含まない状態で回収出来る点で優れていると考えられます。

Fig.1 エクソソーム分離のプロトコル 1
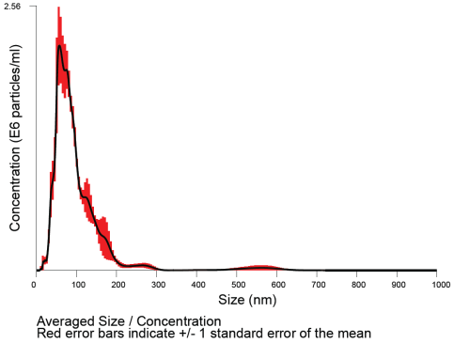
Fig.2 動的光散乱によるサイズ分布
超遠心法により分取したエクソソームを動的光散乱装置Nanosightにより解析した結果です。
尤も、いずれの方法に関しても抗体による蛍光標識を行わない動的光散乱法での解析のみでは粒子のサイズしか確認出来ないため、エクソソームと同じ位置に検出される不純物が存在している点には注意が必要です。現在でも電子顕微鏡で粒子の確認を行うことが確実とされていますが、誰でも手軽に使用出来る機材ではないことから一般化は難しいようです。
超遠心機は、現在ではその安全性・利便性は 大幅に向上し、大学院生が手軽に使える実験機器の一つになってきています。
エクソソームやmicroRNAはその扱い難さから、一定のコンセンサスの得られた解析方法が無いというのが現状です。上述のような様々な精製方法が開発されてきた経緯の一つには、超遠心機を使用する敷居が高いと感じられた時代があったことが考えられます。しかし現在ではその安全性・利便性は大幅に向上し、大学院生が手軽に使える実験機器の一つになってきています。今後の研究の流れとして、エクソソームの回収については、超遠心法が一般化していくことで種々のデータの信頼性は向上し、互いに比較可能な情報の蓄積に繋がることが期待されます。非常に重要な研究分野の一つであるが故に、研究の裾野を広げ、バイアスのかからないデータを収集しつつ、新たな実験手法が洗練されていくことでしょう。
参考文献
1. Clotilde Thery et al., Isolation and Characterization of Exosomes from Cell Culture Supernatants and Biological Fluids. Current Protocols in Cell Biology (2006) 3.22.1-3.22.29
February 2015
|
エクソソーム研究の最新情報 エクソソーム研究に関する基礎情報を始め、超遠心分離法を用いた分離方法や研究の最前線、エクソソーム研究に役立つ製品情報を紹介しています。 |
|
|
超遠心機 ベックマン・コールターは1947年に初めて超遠心機(超遠心分離機)を販売開始し、現在では高い遠心力・回転数はもちろん、バイオセーフティモデルやリモートコントロール機能などを備えた超遠心機を取り揃えております。様々なチューブや容量に対応するロータやアクセサリ類も取り揃え、エクソソーム分離やウイルスの高純度精製、その他幅広いアプリケーションのご要望にお応えします。 |




