フローサイトメトリーによる生物学的機構の解析
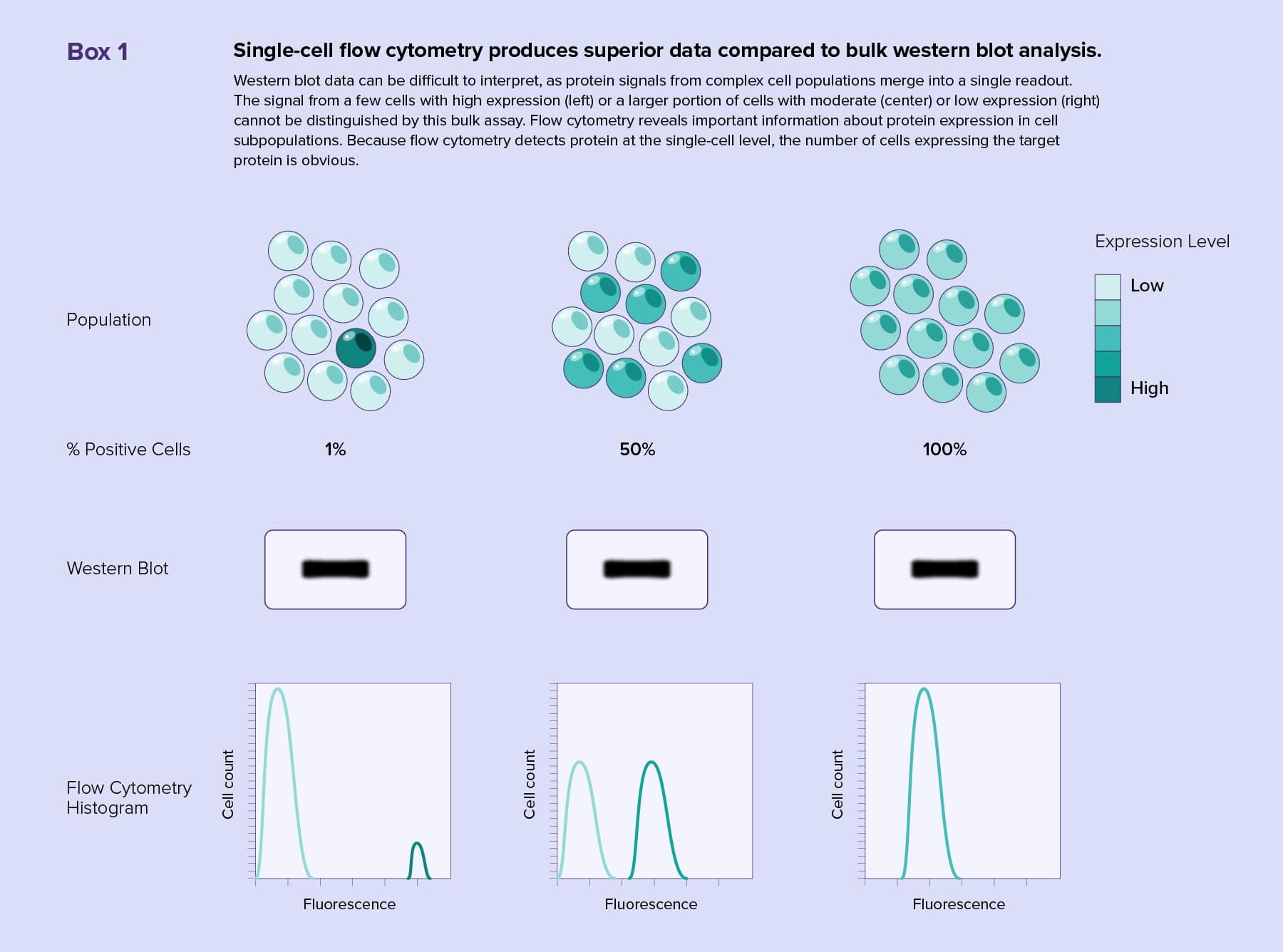
組織サンプル等の不均一な細胞集団で生物学的パラメータを正確に測定することは難しい課題です。従来のバルクな手法で細胞サンプルの解析を行った場合、全ての細胞の平均が得られます。そのシグナル値が目的とする細胞集団全体の低~中程度の発現によるものなのか、あるいは強く発現する少数の細胞によるものかを知る方法はありません。さらに、少数から発せられるシグナルは、細胞数のより多い集団によって埋もれてしまいます。そのため、バルクセル解析では、不均一な集団の希少なフェノタイプや現象が隠れてしまいます。
バルク解析との違い
ウエスタンブロッティングは、タンパク質の検出に一般的に用いられるバルク手法です。この手法ではゲルやプローブメンブレンを使用してバルクサンプルから検出を行いますが、フローサイトメトリーを用いれば、シングルセル(単一の細胞)で解析できるので、ある細胞集団全体の多様性を検出することが可能です。
フローサイトメトリーでは、異なる蛍光標識抗体や染色を使用し、1回の実験で複数の細胞表面マーカーや細胞内マーカーを観察することが可能です。最新のウエスタンブロッティングでも一度に検出できるタンパク質は2~3種類しかなく、不均一なサンプルから目的タンパク質の由来組織を正確に評価することは困難です(Box 1参照)。フローサイトメトリーによる多数のパラメータによる解析(マルチプレックス化)で、細胞のサブタイプの分布や、着目するタンパク質の発現量、タンパク質活性などの情報に富んだ、複雑な定量的データセットが得られます。また、フローサイトメトリーではさらなる解析のために類似した特徴の細胞を分取することも可能です。
ウエスタンブロッティングの検出ステップでは、見たいタンパク質の存在を視覚化するために非常に多くのサンプルを使用しなければなりません。フローサイトメトリーでは、非常に少量のタンパク質、たとえ単一の細胞上のタンパク質でさえも検出できることが、強みの一つです。これは、貴重なサンプルで複数のウエスタンブロッティング解析をするのが困難な場合や、ex vivoで培養が必要だったサンプルを扱う研究者にとってメリットとなります。
フローサイトメトリーを使用したシングルセル解析の初期の例としては、スタンフォード大学のギャリー・ノーラン教授の研究チームが実施した、リン酸化タンパク質の検出による患者のがん細胞内シグナル伝達の解明があります1。キナーゼやリン酸化酵素よるタンパク質のリン酸化は、細胞内に急速な変化をもたらします。細胞シグナリングの変異や遺伝子発現パターンのエピジェネティックな変化は、がんにつながる可能性があります2。この研究では、急性骨髄性白血病患者の30検体から得られた50,000個のシングルセルを複数のパラメータで測定しました。患者サンプルをサイトカインなどで刺激し、リン酸化関連タンパク質に特異的なモノクローナル抗体でリン酸化シグナルが生じていることを検出しました。ウエスタンブロッティングによるアッセイであれば、調べたいタンパク質1つにつき2ブロットが必要でした。1つはリン酸化タンパク質を検出するためのもの、もう1つは全タンパク質レベルの検出のためです。
彼らはデータに基づいてタンパク質活性とフェノタイプと結び付け、シグナル伝達と患者の遺伝的特徴や疾患とを相互に関連付ける何百万ものサイトカイン応答ネットワークを構築しました1。マルチプレックスサイトメトリーが出てくるまで、この規模の研究を実施するのは不可能でした。この研究によって、不均一な腫瘍の微小環境におけるがんのシグナル伝達についての理解が深まりました。
システムバイオロジー
研究者は、俯瞰的包括的な観点で研究対象の生命現象や生物学的機構を理解しようとします。フローサイトメトリーで複数のパラメータを測定することによって、複雑な細胞ネットワークの分子機構を観察することが可能です。生物学的システムについてより深い知見を得ることで、このシステムが健康や疾患にいかに関わっているかの理解を深めることができます。
細胞内
細胞の代謝状態から、細胞内で起こる多くの化学的プロセスについて知ることができます。フローサイトメトリーの抗体パネルにも、代謝酵素、輸送体、フェノタイプマーカーを検出できるものがいくつかあります。タンパク質だけでなく、代謝反応で目的細胞に取り込まれたり、産生または変換される蛍光分子によって、細胞内の現象の理解につながっています。フローサイトメトリーは、がんに反応した免疫細胞3、環境サンプルから採取した培養不可能な病原性バクテリア4、不均一な細胞集団内のがん幹細胞5における代謝変化の検出に用いられています。
がん細胞における好気的解糖の増加などの代謝の変化は、がん細胞の生存と増殖を促進します6 。多くの治療薬が代謝経路を標的としているため、科学者は化学療法に対する細胞応答を予測するためにがん細胞の代謝を解析します7。フローサイトメトリーを用いて単一の乳がん細胞中にある自家蛍光を示す代謝補酵素NADH、NADPH (総称NAD(P)H) 及びFADを追跡した研究例8 では、治療に応答した乳がん細胞の NAD(P)H/FADの比率は、治療に反応のなかった乳がん細胞より低い結果となり、フローサイトメトリーによる蛍光補酵素の検出が、感受性細胞と抵抗性細胞を識別する有効な手段であることが証明されました。現在では、フローサイトメトリーを使って不均一な組織サンプル中のがん細胞の代謝を解析し、治療に抵抗性を示しそうなサプポピュレーションを同定することが可能です。
細胞間
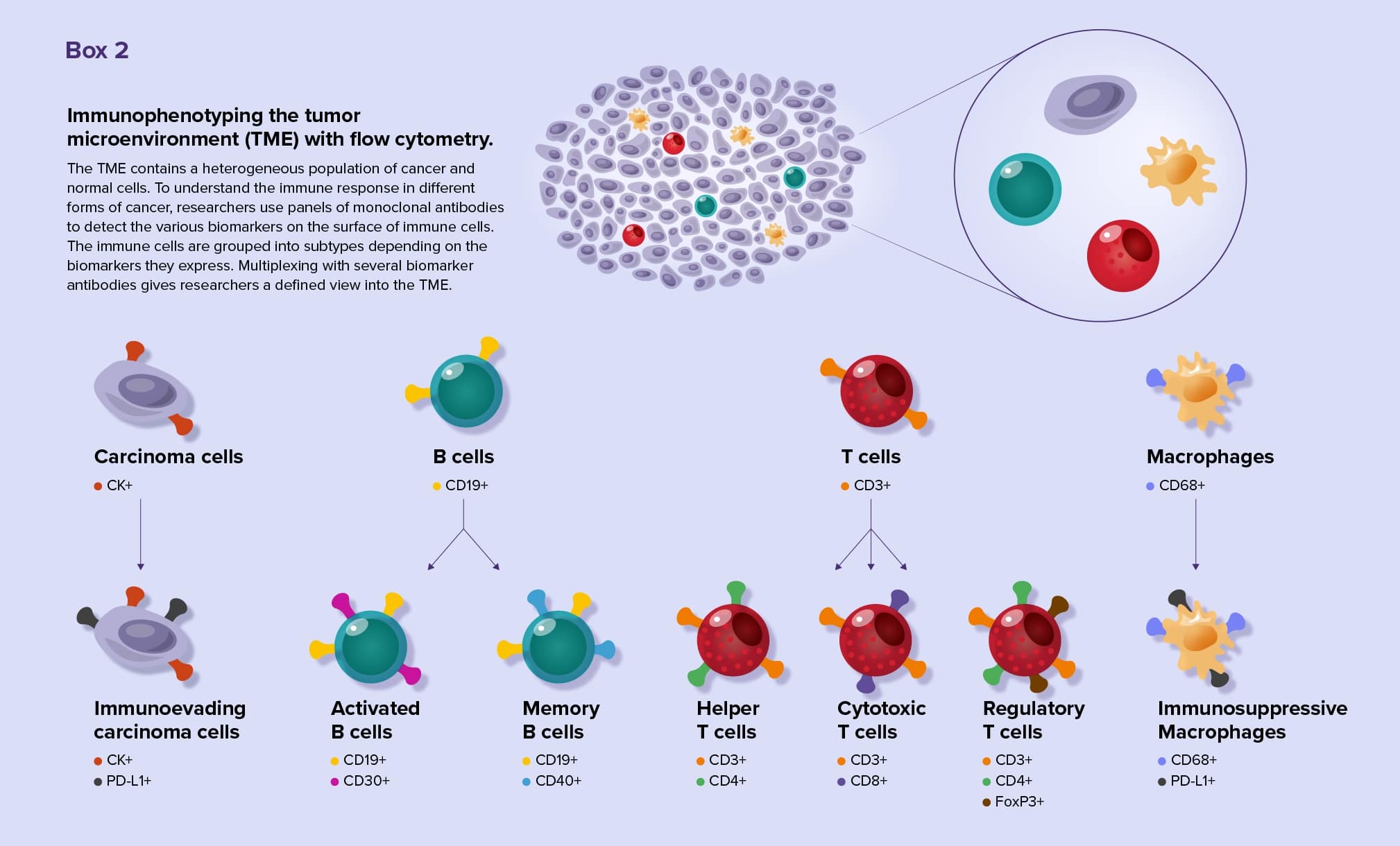
シングルセル技術の出現で、多様な種類のがんの腫瘍微小環境(tumor microenvironments, TME)に関する知見が日々得られるようになりました。腫瘍内はがん細胞と正常細胞が不均一に混在しています。フローサイトメトリーを用いることで、研究者はTMEに存在する細胞の種類を同定し、細胞分裂などの細胞プロセスやシグナル伝達イベント、そして変異を検出することが可能です9。
マルチプレックスフローサイトメトリーは、腫瘍浸潤リンパ球(tumor infiltrating lymphocytes, TIL)などの免疫細胞を研究している研究者には特に有用です。TILは非常に多様で、腫瘍細胞に対する免疫応答が増強されることも弱まることもあります。研究者は、イムノフェノタイピングと呼ばれる手法を使って細胞表面のバイオマーカーを解析し、TILのサブタイプを同定します。現在ではフローサイトメトリーのイムノフェノタイピング用の標準化された抗体パネルを使用することもできます10(Box2参照)。
各細胞のバイオマーカーを調べることで、研究者はサンプルに存在する様々なTILサブセットを正しく識別し、その細胞の機能や役割を理解します。バイオマーカーを解析することで、がん細胞が免疫システムを回避することができる腫瘍特性を明らかにしたり、予後不良と関連するバイオマーカーを特定したりすることができます11。イムノフェノタイピングによる新規のTILサブタイプの発見は、現在も続いています12。
生物間
マイクロバイオーム(微生物叢)の研究は、環境や人間の健康に関する新たな見解をもたらしています。人体表面に存在する微生物コミュニティは複雑かつダイナミックです。マイクロバイオームは宿主である人間の健康に影響を及ぼすことから13 マイクロバイオームを確実に解析できる手法が強く求められています。従来、研究者は培養法で微生物コミュニティの解析を行ってきましたが、微生物の多くは培養が不可能です。次世代シークエンスによってマイクロバイオームサンプルの分類学的情報が大量に提供されている一方、ルーチンの解析手法となるには程遠いのが実情です。この手法は、集団における微生物の多様性を多く見積もる傾向にあること、標準化が容易でないこと、コストがかかること、データの分類にバイオインフォマテクスの専門知識を持つ人による解析が必要です14 DNA抽出の失敗は結果をゆがめてしまう可能性があることから、サンプル調整時に細胞溶解が難しい生物種であるほどデータへの反映が少なくなってしまいます。
微生物群のダイナミクスを徐々に明らかにするには、高解像度フローサイトメトリーあるいはサイトメトリック・マイクロバイオーム・プロファイリングを使用したシングルセルベースでのマイクロバイオーム解析を用いることができます。この手法では、微生物サンプルの前方散乱光で細胞の大きさを測定し、蛍光色素DAPIで染色して定量的なDNA量を測定します。この2つのパラメータで、一回の実験で微生物サンプル内の50以上の系統的なサブポピュレーションを分類できます15。研究者は経時的にマイクロバイオームを測定し、異なる条件下での細胞構成や数の変化を評価します。また、同定できた集団をセルソーティングで分取し、他の分子生物学手法による解析に用いることもできます。
参考文献
- Irish JM et al. Single cell profiling of potentiated phospho-protein networks in cancer cells. Cell 2004;118:217-28.
- Hanahan D and RA Weinberg. The hallmarks of cancer. Cell 2000;100:57-70.
- Ahl PJ et al. Met-Flow, a strategy for single-cell metabolic analysis highlights dynamic changes in immune subpopulations. Commun Biol 2020;3:1-15.
- Morishige Y et al. Use of flow cytometry for quantitative analysis of metabolism of viable but non-culturable (VBNC) Salmonella. Biol Pharm Bull 2015;38:1255-64.
- Yuan Y et al. Autofluorescence of NADH is a new biomarker for sorting and characterizing cancer stem cells in human glioma. Stem Cell Res Ther 2019;10:330.
- Liberti, MV and JW Locasale. The Warburg effect: How does it benefit cancer cells? Trends Biochem Sci 2016;41:211-18.
- Zhao Y et al. Targeting cellular metabolism to improve cancer therapeutics. Cell Death Dis 2013;4:e532.
- Shah AT et al. Autofluorescence flow sorting of breast cancer cell metabolism. J Biophotonics 2017;10:1026-33.
- Irish JM et al. Mapping normal and cancer cell signalling networks: towards single-cell proteomics. Nat Rev Cancer 2006;6:146-55.
- Finak G et al. Standardizing flow cytometry immunophenotyping analysis from the Human ImmunoPhenotyping Consortium. Sci Rep 2016;6:20686.
- Costa AFO et al. Role of new immunophenotypic markers on prognostic and overall survival of acute myeloid leukemia: a systematic review and meta-analysis. Sci Rep 2017;7:4138.
- Villani AC et al. Single-cell RNA-seq reveals new types of human blood dendritic cells, monocytes, and progenitors. Science 2017;356.
- Dzutsev A et al. The role of the microbiota in inflammation, carcinogenesis, and cancer therapy. Eur J Immunol 2015;45:17-31.
- Esser C et al. Beyond sequencing: fast and easy microbiome profiling by flow cytometry. Arch Toxicol 2019;93:2703-04.
- Zimmermann Z et al. High-resolution microbiota flow cytometry reveals dynamic colitis-associated changes in fecal bacterial composition. Eur J Immunol 2016;46:1300-03.
組織サンプル等の不均一な細胞集団で生物学的パラメータを正確に測定することは難しい課題です。従来のバルクな手法で細胞サンプルの解析を行った場合、全ての細胞の平均が得られます。そのシグナル値が目的とする細胞集団全体の低~中程度の発現によるものなのか、あるいは強く発現する少数の細胞によるものかを知る方法はありません。さらに、少数から発せられるシグナルは、細胞数のより多い集団によって埋もれてしまいます。そのため、バルクセル解析では、不均一な集団の希少なフェノタイプや現象が隠れてしまいます。
バルク解析との違い
ウエスタンブロッティングは、タンパク質の検出に一般的に用いられるバルク手法です。この手法ではゲルやプローブメンブレンを使用してバルクサンプルから検出を行いますが、フローサイトメトリーを用いれば、シングルセル(単一の細胞)で解析できるので、ある細胞集団全体の多様性を検出することが可能です。
フローサイトメトリーでは、異なる蛍光標識抗体や染色を使用し、1回の実験で複数の細胞表面マーカーや細胞内マーカーを観察することが可能です。最新のウエスタンブロッティングでも一度に検出できるタンパク質は2~3種類しかなく、不均一なサンプルから目的タンパク質の由来組織を正確に評価することは困難です(Box 1参照)。フローサイトメトリーによる多数のパラメータによる解析(マルチプレックス化)で、細胞のサブタイプの分布や、着目するタンパク質の発現量、タンパク質活性などの情報に富んだ、複雑な定量的データセットが得られます。また、フローサイトメトリーではさらなる解析のために類似した特徴の細胞を分取することも可能です。
ウエスタンブロッティングの検出ステップでは、見たいタンパク質の存在を視覚化するために非常に多くのサンプルを使用しなければなりません。フローサイトメトリーでは、非常に少量のタンパク質、たとえ単一の細胞上のタンパク質でさえも検出できることが、強みの一つです。これは、貴重なサンプルで複数のウエスタンブロッティング解析をするのが困難な場合や、ex vivoで培養が必要だったサンプルを扱う研究者にとってメリットとなります。
フローサイトメトリーを使用したシングルセル解析の初期の例としては、スタンフォード大学のギャリー・ノーラン教授の研究チームが実施した、リン酸化タンパク質の検出による患者のがん細胞内シグナル伝達の解明があります1。キナーゼやリン酸化酵素よるタンパク質のリン酸化は、細胞内に急速な変化をもたらします。細胞シグナリングの変異や遺伝子発現パターンのエピジェネティックな変化は、がんにつながる可能性があります2。この研究では、急性骨髄性白血病患者の30検体から得られた50,000個のシングルセルを複数のパラメータで測定しました。患者サンプルをサイトカインなどで刺激し、リン酸化関連タンパク質に特異的なモノクローナル抗体でリン酸化シグナルが生じていることを検出しました。ウエスタンブロッティングによるアッセイであれば、調べたいタンパク質1つにつき2ブロットが必要でした。1つはリン酸化タンパク質を検出するためのもの、もう1つは全タンパク質レベルの検出のためです。
彼らはデータに基づいてタンパク質活性とフェノタイプと結び付け、シグナル伝達と患者の遺伝的特徴や疾患とを相互に関連付ける何百万ものサイトカイン応答ネットワークを構築しました1。マルチプレックスサイトメトリーが出てくるまで、この規模の研究を実施するのは不可能でした。この研究によって、不均一な腫瘍の微小環境におけるがんのシグナル伝達についての理解が深まりました。
システムバイオロジー
研究者は、俯瞰的包括的な観点で研究対象の生命現象や生物学的機構を理解しようとします。フローサイトメトリーで複数のパラメータを測定することによって、複雑な細胞ネットワークの分子機構を観察することが可能です。生物学的システムについてより深い知見を得ることで、このシステムが健康や疾患にいかに関わっているかの理解を深めることができます。
細胞内
細胞の代謝状態から、細胞内で起こる多くの化学的プロセスについて知ることができます。フローサイトメトリーの抗体パネルにも、代謝酵素、輸送体、フェノタイプマーカーを検出できるものがいくつかあります。タンパク質だけでなく、代謝反応で目的細胞に取り込まれたり、産生または変換される蛍光分子によって、細胞内の現象の理解につながっています。フローサイトメトリーは、がんに反応した免疫細胞3、環境サンプルから採取した培養不可能な病原性バクテリア4、不均一な細胞集団内のがん幹細胞5における代謝変化の検出に用いられています。
がん細胞における好気的解糖の増加などの代謝の変化は、がん細胞の生存と増殖を促進します6 。多くの治療薬が代謝経路を標的としているため、科学者は化学療法に対する細胞応答を予測するためにがん細胞の代謝を解析します7。フローサイトメトリーを用いて単一の乳がん細胞中にある自家蛍光を示す代謝補酵素NADH、NADPH (総称NAD(P)H) 及びFADを追跡した研究例8 では、治療に応答した乳がん細胞の NAD(P)H/FADの比率は、治療に反応のなかった乳がん細胞より低い結果となり、フローサイトメトリーによる蛍光補酵素の検出が、感受性細胞と抵抗性細胞を識別する有効な手段であることが証明されました。現在では、フローサイトメトリーを使って不均一な組織サンプル中のがん細胞の代謝を解析し、治療に抵抗性を示しそうなサプポピュレーションを同定することが可能です。
細胞間
シングルセル技術の出現で、多様な種類のがんの腫瘍微小環境(tumor microenvironments, TME)に関する知見が日々得られるようになりました。腫瘍内はがん細胞と正常細胞が不均一に混在しています。フローサイトメトリーを用いることで、研究者はTMEに存在する細胞の種類を同定し、細胞分裂などの細胞プロセスやシグナル伝達イベント、そして変異を検出することが可能です9。
マルチプレックスフローサイトメトリーは、腫瘍浸潤リンパ球(tumor infiltrating lymphocytes, TIL)などの免疫細胞を研究している研究者には特に有用です。TILは非常に多様で、腫瘍細胞に対する免疫応答が増強されることも弱まることもあります。研究者は、イムノフェノタイピングと呼ばれる手法を使って細胞表面のバイオマーカーを解析し、TILのサブタイプを同定します。現在ではフローサイトメトリーのイムノフェノタイピング用の標準化された抗体パネルを使用することもできます10(Box2参照)。
各細胞のバイオマーカーを調べることで、研究者はサンプルに存在する様々なTILサブセットを正しく識別し、その細胞の機能や役割を理解します。バイオマーカーを解析することで、がん細胞が免疫システムを回避することができる腫瘍特性を明らかにしたり、予後不良と関連するバイオマーカーを特定したりすることができます11。イムノフェノタイピングによる新規のTILサブタイプの発見は、現在も続いています12。
生物間
マイクロバイオーム(微生物叢)の研究は、環境や人間の健康に関する新たな見解をもたらしています。人体表面に存在する微生物コミュニティは複雑かつダイナミックです。マイクロバイオームは宿主である人間の健康に影響を及ぼすことから13 マイクロバイオームを確実に解析できる手法が強く求められています。従来、研究者は培養法で微生物コミュニティの解析を行ってきましたが、微生物の多くは培養が不可能です。次世代シークエンスによってマイクロバイオームサンプルの分類学的情報が大量に提供されている一方、ルーチンの解析手法となるには程遠いのが実情です。この手法は、集団における微生物の多様性を多く見積もる傾向にあること、標準化が容易でないこと、コストがかかること、データの分類にバイオインフォマテクスの専門知識を持つ人による解析が必要です14 DNA抽出の失敗は結果をゆがめてしまう可能性があることから、サンプル調整時に細胞溶解が難しい生物種であるほどデータへの反映が少なくなってしまいます。
微生物群のダイナミクスを徐々に明らかにするには、高解像度フローサイトメトリーあるいはサイトメトリック・マイクロバイオーム・プロファイリングを使用したシングルセルベースでのマイクロバイオーム解析を用いることができます。この手法では、微生物サンプルの前方散乱光で細胞の大きさを測定し、蛍光色素DAPIで染色して定量的なDNA量を測定します。この2つのパラメータで、一回の実験で微生物サンプル内の50以上の系統的なサブポピュレーションを分類できます15。研究者は経時的にマイクロバイオームを測定し、異なる条件下での細胞構成や数の変化を評価します。また、同定できた集団をセルソーティングで分取し、他の分子生物学手法による解析に用いることもできます。
参考文献
- Irish JM et al. Single cell profiling of potentiated phospho-protein networks in cancer cells. Cell 2004;118:217-28.
- Hanahan D and RA Weinberg. The hallmarks of cancer. Cell 2000;100:57-70.
- Ahl PJ et al. Met-Flow, a strategy for single-cell metabolic analysis highlights dynamic changes in immune subpopulations. Commun Biol 2020;3:1-15.
- Morishige Y et al. Use of flow cytometry for quantitative analysis of metabolism of viable but non-culturable (VBNC) Salmonella. Biol Pharm Bull 2015;38:1255-64.
- Yuan Y et al. Autofluorescence of NADH is a new biomarker for sorting and characterizing cancer stem cells in human glioma. Stem Cell Res Ther 2019;10:330.
- Liberti, MV and JW Locasale. The Warburg effect: How does it benefit cancer cells? Trends Biochem Sci 2016;41:211-18.
- Zhao Y et al. Targeting cellular metabolism to improve cancer therapeutics. Cell Death Dis 2013;4:e532.
- Shah AT et al. Autofluorescence flow sorting of breast cancer cell metabolism. J Biophotonics 2017;10:1026-33.
- Irish JM et al. Mapping normal and cancer cell signalling networks: towards single-cell proteomics. Nat Rev Cancer 2006;6:146-55.
- Finak G et al. Standardizing flow cytometry immunophenotyping analysis from the Human ImmunoPhenotyping Consortium. Sci Rep 2016;6:20686.
- Costa AFO et al. Role of new immunophenotypic markers on prognostic and overall survival of acute myeloid leukemia: a systematic review and meta-analysis. Sci Rep 2017;7:4138.
- Villani AC et al. Single-cell RNA-seq reveals new types of human blood dendritic cells, monocytes, and progenitors. Science 2017;356.
- Dzutsev A et al. The role of the microbiota in inflammation, carcinogenesis, and cancer therapy. Eur J Immunol 2015;45:17-31.
- Esser C et al. Beyond sequencing: fast and easy microbiome profiling by flow cytometry. Arch Toxicol 2019;93:2703-04.
- Zimmermann Z et al. High-resolution microbiota flow cytometry reveals dynamic colitis-associated changes in fecal bacterial composition. Eur J Immunol 2016;46:1300-03.