免疫療法によってがん治療に新たな将来性が期待される
「T細胞促進剤のヒット」およびその他の進捗の早い戦略

2017年、免疫療法の研究に関心のある人たちが、洞察に満ちた2つのウェビナーへ参加するよう招待されました。一方は、ニューヨーク大学のPerlmutterがんセンターで胸部腫瘍内科の医局長を務めるLeena Gandhi博士を特集したものです。他方は、ニューヨークシティのがん研究所(CRI)で科学総務部のCEOおよび部長を務めるJill O’Donnell-Tormey博士による発表を収録したものです。
Gandhi博士の研究は、肺がんに対する早期薬剤開発、特に治療のための新たな免疫療法の組み合わせを使用する可能性に焦点を当てています。
O’Donnell-Tormey博士は1987年にCRIに配属され、1993年からCEOを務めています。CRIに配属される前は、Rockefeller大学の細胞生理学および免疫学のCRI博士研究員でした。
現在、2人ともニューヨークシティで勤めているという事実に加え、これら2人の専門家は免疫療法について同じような意見を持っています。過去数十年に多くの浮き沈みがあったものの、将来のがん治療を開発するという役割は有望視されています。
中止と開始:免疫療法の初期
O’Donnell-Tormey博士は、1970年を振り返り、特にモノクローナル抗体が「がんに対する魔法の弾丸」と呼ばれたことに言及しながら、「免疫療法は過度に寄せられた期待に苦しんでいました」と、語っています。残念ながら、その後すぐに、「魔法の弾丸」のほとんどが空包であることが判明しました。
「実現に至らなかったとき、全員がこの分野全般に関する多くの楽観論を捨てました。」
免疫療法の初期の特徴は、開始と中止ですが、明らかに開始するよりも中止することが多かったです。1970年代の「魔法の弾丸」の失敗後、1980年代にはリンパ腫を対象に、最初のモノクローナル抗体の試験が行われましたが、この試験は失敗に終わりました。しかし、1980年代後半には、黒色腫の治療薬としてインターフェロンγが承認されました。1991年、始めて腫瘍抗原が特定され、実際にヒトの免疫力を利用してがん細胞を直接攻撃できるかもしれないという新たな希望が生まれました。
1997年、成功を収めた最初のモノクローナル抗体(リツキシマブ)が初めて承認され、1990年代には多くのがんワクチンが失敗に終わったものの、多くの研究者が、がん予防の強力な新戦略になる可能性があると考えました。ヒトパピローマウイルス(HPV)に関連するがんを防ぐ能力が実証されたワクチンを除くと、免疫療法の分野における成功事例は依然として少なく、成功には長い年数が必要になると考えられました。
2010年以降、免疫療法は急速な発展を遂げ、O’Donnell-Tormey博士の言葉を借りるならば、免疫療法は再び「腫瘍学の注目分野」となりました。
「1991年、始めて腫瘍抗原が特定され、実際にヒトの免疫力を利用できるかもしれないという新たな希望が生まれました。」
2011年、抗CTLA-4チェックポイント阻害薬が転移性黒色腫に対して承認され、後期黒色腫において全生存率に影響を与える第一選択療法になりました。それ以降、FDAは12種類のがんに対して13通りの異なる免疫療法を承認しています。
「Science誌は、2013年を(免疫療法の)大きな躍進の年と名づけました。さらに、免疫療法は2016年の米国臨床腫瘍学会(ASCO)における最も重要なトピックとして扱われました」と、O’Donnell-Tormey博士はASCOに言及しながら語っています。「6月に行われた直近のASCO会議では、多数の出席者が免疫療法について議論しました。免疫療法が会議の最終日に小さな会議室に追いやられて、誰も参加しなかった10年前に比べると、大きな変化です。」
2013年に免疫療法を「大きな躍進」と評価した皮肉は、Ghandi博士には通用しませんでした。Ghandi博士は、免疫療法はがん治療において全く新しい概念ではないというO’Donnell-Tormey博士による喚起を繰り返します。ただし、Ghandi博士は、能動免疫療法と受動免疫療法を区別しています。特に、受動免疫療法は現在、博士および彼女の同僚である腫瘍科医の間で大きな関心を呼んでいます。
「腫瘍に対する応答を刺激する能動免疫療法には、サイトカイン療法およびがんワクチンが含まれます。この療法も、多くの異なるタイプの腫瘍において長年注目を集めてきました。」
「逆に、受動免疫療法では、腫瘍またはその微小環境において免疫反応に対する阻害が遮断されます。」 これは腫瘍治療における新しい概念であり、抗CTLA-4抗体の開発で始まりました。最近、この分野は、抗PD-1抗体または抗PD-L1抗体の開発に移行しています。」
これらの特異的な抗体はチェックポイント阻害薬を作製します。このチェックポイント阻害薬によって、がん治療のための新しい免疫療法に対する研究者の情熱が明らかに蘇りました。
注意:今後のチェックポイント
チェックポイントはどのように作用を阻害するのでしょうか? O’Donnell-Tormey博士は、このプロセスを自動車の運転に例えます。
彼女の説明によると、「T細胞を活性化して、がん細胞を破壊できるエフェクター細胞に変えるには、2つのシグナルが必要です。まず、T細胞受容体は、樹状細胞などによって提示された主要組織適合複合体(MHC)抗原を特定するマーカーを「見る」必要があります。このシグナルだけでは、T細胞は活性化されず、休眠して死滅します。抗原提示細胞(APC)の表面にあるB7マーカーとT細胞上の表面にあるCD28と呼ばれるマーカーを結合する、2つ目のシグナルが必要になります。これら2つのシグナルが同時に発生すると、T細胞は活性化されます。
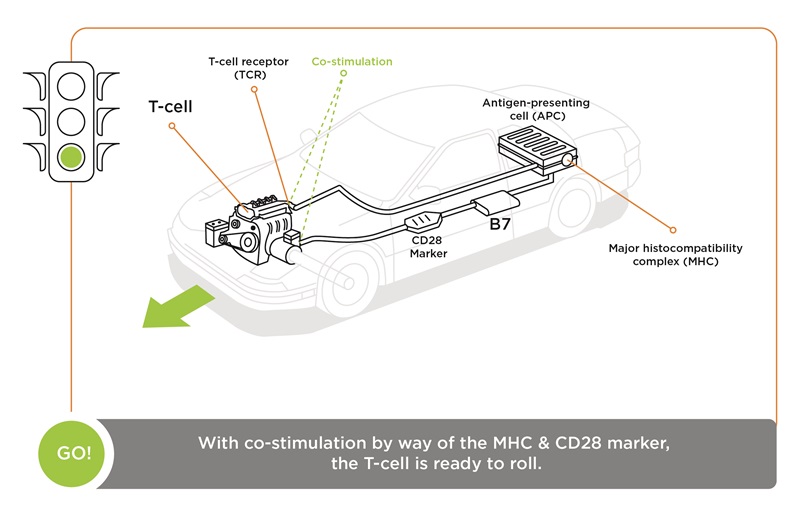
「免疫系には、自然による抑制と均衡の機能を備えています。この機能のひとつがCTLA-4で、私たちはこれを「ブレーキ」と呼んでいます。2つのシグナルがT細胞を活性化させると、T細胞の表面にCTLA-4が発現し、B7分子に結合するCD28を打ち負かすことができます。CTLA-4がB7に結合すると、停止シグナルが伝達されます。これにより、T細胞は活性化を停止し、休眠状態に入ります。
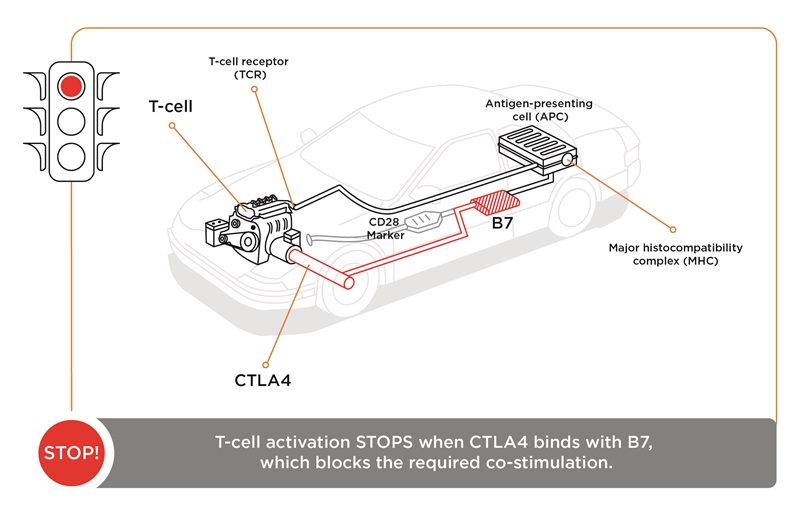
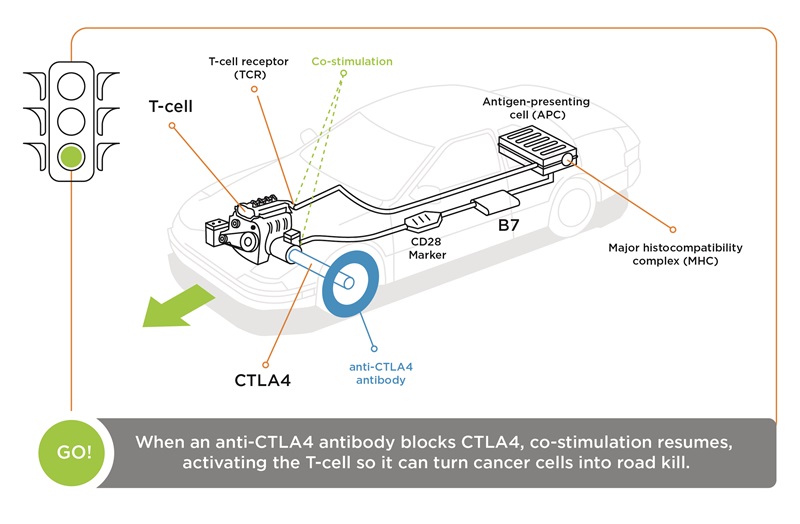
「チェックポイント阻害薬によって、抗体が作製され、ブレーキであるCTLA-4分子と結合すると、B7と結合できなくなるため、T細胞は活性化の状態を保ちます。簡単に言えば、CTLA-4に対する抗体は免疫系にかかったブレーキを解除します。
免疫系を自動車に例えると、最初のシグナルである、T細胞受容体と抗原MHCの結合は、キーを差し込んでエンジンを始動させるのと同じです。しかし、自動車はアクセルを踏むまで動きません。免疫系のアクセルペダルはCD28とB7です。自動車を停止させるにはブレーキを踏む必要があります。ここで、CTLA-4とB7がブレーキとして機能します。つまり、CTLA-4がB7に結合するのを阻止すると、T細胞が作用し続けるため、自動車は走り続けます。」
標的となるプログラム細胞死タンパク質1(PD-1)や、そのリガンドであるPD-L1などの他のチェックポイント阻害薬も、がん細胞が免疫系による自然の抑制と均衡を取り込むときに反撃します。
がん細胞がPD-L1を発現し、T細胞上のPD-1受容体と結合するため、腫瘍細胞を「見えなく」することによって、本質的に免疫系が遮断されます。PD-L1またはT細胞の表面にあるPD-1のどちらにも結合する抗体を作製することによって、相互作用を停止し、T細胞が「見える」ようになり、腫瘍細胞を破壊できるようになります。
これまで、FDAは6種類のチェックポイント阻害薬を承認しています。そのうちの1つは抗CTLA-4に対する阻害薬で、残りはPD-1またはPD-L1に対する阻害薬です。これらのチェックポイント阻害薬は、7種類の異なるがんに対して承認されており、進行期のがんだけでなく、黒色腫、膀胱がん、非小細胞肺がんも対象とする最先端の治療法として使用できます。
O’Donnell-Tormey博士によると、「黒色腫などの転移率が高いがんの間には相関関係があり、チェックポイント阻害薬に対する応答率が40%~45%と高くなります。しかし、前立腺や子宮の肉腫のような一部のがん細胞は、チェックポイント阻害薬に対する応答を示しません。
「そして、10%~40%の範囲でばらつきが見られます。これらは満足のいく結果ですが、さまざまな種類のがんを有する患者の部分集団のみが、チェックポイント阻害薬に応答していることも意味しています。」
簡単に言えば、CTLA-4に対する抗体は、免疫系にかかったブレーキを解除します。
Ghandi博士は、すでにこの問題に取り組んでいます。
「応答を可能にするという点で、腫瘍細胞に発現するPD-L1の予測値については議論が続いています。」 「私たちは長期的なベネフィットを得られた患者の部分集団しか知りませんが、これらの患者を特定する最善の方法については、依然として問題が解決されていません。
「異なる種類のがんにおける体細胞変異の頻度を評価する大規模な研究の結果、PD-1およびPD-L1の阻害薬から最もベネフィットを得られるがんの種類には、共通点があることが分かっています。これらすべてのがんにおいて、変異負荷の高いことが確認されています。PD-1を使用した治療で最初に承認されたのは黒色腫を対象にしたもので、2番目は肺がん、3番目は膀胱がんを対象にしています。これらはすべて全体の変異負荷が高いがんであり、研究の結果と一致します。
「DNAレベルで腫瘍細胞に多数の変異変化が発生すると、腫瘍の免疫原性が高まり、免疫系による認識が可能になることが期待されます。」
チェックポイント阻害療法についてはさらなる研究が必要ですが、最終的には多くの種類のがんに対する第一選択療法になると期待されます。実際、PD-1チェックポイント阻害薬は、化学療法や放射線療法よりも優れた選択肢として既に使用されています。PD-1チェックポイント阻害薬の効果は他の療法と同じ効果を示しますが、重度の副作用が少ないことが利点です。
現在、免疫療法に関するほとんどの研究において、CTLA-4およびPD-1に焦点が当てられていますが、最終的に注目を集めると思われる、他のチェックポイント阻害薬の発見が期待されています。今のところ、複数のチェックポイントが腫瘍のPD-L1およびPD-1と共発現することが確認されています。この結果、これらの分子の一部は、間もなく臨床試験で検討される予定であり、これらの多くは抗PD-1または抗PD-L1の阻害薬と併用されています。
免疫療法の有望性:もはやキメラではない?
最近、チェックポイント阻害薬に加えて、ある治療法がメディアで注目を集めています。これは、ジミー・カーター元大統領の黒色腫の治療において成功を収めた治療法です。この有望な免疫療法が、最近になって脚光を浴びています。キメラ抗原受容体発現(CAR)T細胞は、患者自身の血液から採取され、遺伝子操作を施した後に、再び患者に戻される免疫細胞です。
特に、患者のT細胞を採取してラボラトリーまたは医薬品の製造施設に送付し、そこで表面にキメラ抗原受容体(CAR)を発現するよう遺伝子操作を施します。CARは、個々の患者において、標的となる腫瘍細胞の表面にある特異的な抗原を、T細胞に認識させるためのタンパク質です。
再操作された細胞はラボラトリーで増殖され、治療に十分な量が得られるまで、各「バッチ」の(何百万もの)細胞を凍結保管します。その後、病院または治療センターに送付され、患者に注入されます。患者の多くは短期間にわたる化学療法を受けてから、CAR-T細胞の注入を受けます。
注入後、CAR-T細胞は増殖し、仮想軍隊である「攻撃」細胞を作製します。この攻撃細胞が、表面に標的となる抗原を持つがん細胞を認識し、死滅させます。
CAR-T細胞は、注入後に長期間にわたり体内に滞留するため、最初の戦争に勝利した後に、患者をがんの再発から保護します。結果的に、CAR-T細胞によって長期的な寛解が維持できるようになっています。
「この応答率は注目に値します」と、O’Donnell-Tormey博士は述べます。「白血病については、その種類に応じて60%~100%の応答率が認められています。」 残念ながら、一部の副作用は重度で、有害事象の発生率は顕著です。
CAR-T細胞療法への注目に水を差すのは、副作用に関する課題だけではありません。
「CAR-T細胞療法は個人に対するカスタマイズが必要になるため、コストが非常に高くなります。誤解しないでください。これらの治療法はすべて高価なものです。PD-1阻害薬のコストは天文学的な金額で、腫瘍学の世界では前代未聞です。しかし、CAR-T細胞療法は、その一段階上を行きます。」
2017年、FDAは、小児および若年成人患者における前駆B細胞急性リンパ芽球性白血病の治療薬として、最初のCAR-T細胞療法のTisagenlecleucelを承認しました。患者あたりの推定コストは500,000ドルを超えますが、この新しい形態の治療が興奮と論争によって迎えられたことは不思議ではありません。
自家骨髄移植のコスト(通常350,000ドル)などを含む、この種の白血病の治療にかかる現在のコストを考慮すると、一部の医師はTisagenlecleucelを重視しています。将来の危うい白血病患者は、CAR-T細胞療法のような複雑で新しい治療法のコスト/ベネフィット比を比較するための唯一のコホートとなっています。
しかし、コスト/ベネフィット/価値に関する論議に参加するのではなく、Ghandi博士とO’Donnell-Tormey博士は、むしろ免疫療法を使用した別の有望な戦略である、併用療法に着目しています。
相乗効果:併用療法の威力
Ghandi博士は、免疫療法の併用を評価するため、多くの治験が実施されていると指摘します。
「最も頻繁に評価され、少なくとも黒色腫の治療に変化をもたらしたのが、PD-1阻害薬とCTLA-4阻害薬の併用です。」
「これは併用療法について初めて評価された分野で、複数の大規模な治験で併用療法が単剤療法よりも優れていることが実証されました。」
「この治験は意義深いものです。なぜなら、あらゆる単剤療法と比べて、併用療法で全体的な向上が認められたからです。」 しかし、PD-L1陽性の患者にとっては、実際のところ、併用療法と単剤療法の間に差異はありません。一番大きな差異が認められるのは、PD-L1陰性の患者です。
「これは、次の2つの理由から重要です。潜在的に毒性のある物質を患者に投与するのを防ぐため、患者に与える治療回数を減らしたい、というのが一つ目の理由です。しかし、抗PD-1またはPD-L1の療法自体から副作用を受ける可能性のない、または可能性のほとんどない患者に対してベネフィットを提供したい、というのが2つ目の理由です。
「現在、肺がんに関する多くの臨床試験では、免疫療法の併用に焦点を当てています。」
O’Donnell-Tormey博士は、現在開発中である新しい併用療法に関するGhandi博士の予測に同意し、免疫療法に特有の相乗効果に注目しています。
「他の免疫療法と併用するだけでなく、放射線療法や化学療法と併用することもできます。さらに、標的を絞ることもできます。免疫系ががん細胞の表面にあるマーカーをどのように「見る」ことができるか正確に理解すれば、応答が直接がん細胞に向けられ、正常な細胞を攻撃しないように標的を設定できるため、あらゆるがん治療にとって明らかに優れた結果が期待されます。」
 「チェックポイント阻害薬またはCAR-T細胞を他の治療法またはそれら自体と併用することで、長期間にわたり治療に応答する患者の数が増えます。」 がんに対して効果的な免疫応答を得るため、様々な段階を踏むことから、併用療法は理にかなっています。これは、1段階のプロセスではありません。」
「チェックポイント阻害薬またはCAR-T細胞を他の治療法またはそれら自体と併用することで、長期間にわたり治療に応答する患者の数が増えます。」 がんに対して効果的な免疫応答を得るため、様々な段階を踏むことから、併用療法は理にかなっています。これは、1段階のプロセスではありません。」
Ghandi博士は、ここで自身の経験を話しながら同意します。「肺がんにおける治験では、この併用療法に関して毒性が増加するという、非常に重大な問題が見つかっています。しかし、併用療法を使用して毒性増加を軽減する方法として、投与スケジュールと併用薬剤の投与量を変更することが考えられます」と、彼女は語っています。
O’Donnell-Tormey博士が述べたように、特定の免疫療法の併用は、新しく効果的ながん治療を特定する上で可能となる唯一の戦略です。Ghandi博士は、化学療法、放射線療法、その他の標的療法を受けたことのある患者が、その後の免疫療法に対する応答が低くなるか、高くなるかに関心を寄せています。
「これは、研究において重要事項になると思います。なぜなら、大部分の患者は、これらの治療を受ける可能性が高いからです。がん治療において、これらのツールがなくなることはないでしょう。
実際、肺がんに関する現行の臨床試験の大部分は、免疫療法の併用に焦点を当てており、併用する可能性のある候補は数多く存在します。
「化学療法には免疫抑制があり、由来サプレッサー細胞の枯渇につながります。理論的には、腫瘍の免疫原性が向上するはずです。放射線療法についても同じことが言えます。」
第一選択療法としての免疫療法がその後の化学療法など、従来のツールの使用を大きく成功させるのに役立つかもしれないという意見は正しいでしょうか? 一部の研究者は、免疫療法が本質的に化学療法への応答を「刺激する」と仮定しています。
「これは単なる推測ではないと思います」と、Ghandiは述べています。「しかし、この疑問は未だに解明されていません。」
ただし、免疫療法を含む併用療法が、いつか単剤療法を追い越し、多様ながんに対する標準的な治療法になるかもしれないという仮定は正しいと思います。その日が来るまで、研究者は、その患者が特別な併用療法から最大限のベネフィットを得て、併用療法に起因する副作用による影響を最小限に抑えることができるか特定するという、手ごわい課題に引き続き直面するでしょう。
今後の免疫療法:研究によって新たな発見が促進されるのか?
 O’Donnell-Tormey博士とGhandi博士は2人とも、3歩進んで1歩戻るという免疫療法の進捗状況にもかかわらず、その将来について非常に楽観的です。
O’Donnell-Tormey博士とGhandi博士は2人とも、3歩進んで1歩戻るという免疫療法の進捗状況にもかかわらず、その将来について非常に楽観的です。
「第一に、免疫療法は汎用的で強力です」と、O’Donnell-Tormeyは述べます。「免疫療法は、あらゆる種類のがんに対して有効であると証明されるでしょう。」 がんを治癒できない場合でも、免疫療法を使用することで、がんを管理できる疾患に変えられることが確認されています。さらに、免疫療法は適応可能です。免疫系はいつも未知の課題から私たちを守る準備を整えているので、がんが変異した際に、免疫系がそれに適応して防御を開始するのです。
「過去において、これほど多くの患者が免疫療法に対して良好な応答を示したことはありませんでした。」
「ここ数年間、動物モデルだけでなく、患者においても免疫療法の応答が持続することが確認されています。これは、おそらく免疫系が記憶しているからです。この生得能力は免疫系の特徴のひとつであり、免疫系によるがんの治療が、魅力的な方法となる理由のひとつです。」
Ghandi博士は、これから数年間にわたり免疫療法が目指す道のりを考える際、これまでに達成してきた結果を振り返り、励みとしています。
「私たちは、肺がん患者の約20%が、免疫療法を受けることで長期生存者となることを目の当たりにしました。これらの患者は転移性疾患を有し、1年も生きられないと思われていたのです。」
「3年間で27%の生存率が認められています。これは、肺がんでは不可能と思われる生存率で、2年間の生存率は一般的に11%、3年間の生存率はほぼゼロでした。したがって、これらの患者は、依然として部分集団でありますが、化学療法やその他の多くの標的療法では実現しなかった長期ベネフィットを享受しています。」
過去の失敗を指摘して議論する研究者はほとんどいません。また、最近の成功を考慮すれば、腫瘍の分野における免疫療法の継続的な進歩は、肯定的に受け止められています。「魔法の弾丸」は存在しないでしょうが、最近の進歩によって、最終的にがんを管理または制圧する、効果的な免疫療法の兵器工場を完成する確率は高いと示唆されています。
「長年、この分野に携わってきましたが、私たちはユニークな立場にいると思います」と、O’Donnell-Tormeyは話します。
「過去において、これほど多くの患者が免疫療法に対して良好な応答を示したことはありませんでした。残念ながら、良好な応答を示していない患者も多数存在します。しかし、過去には尋ねることができなかった質問を開始できるプラットフォームが得られました。」
「以前は、がん治療に免疫系を利用することができると信じる人はほとんどいませんでした。今では、誰もが、免疫療法は革新的ながん治療法であると、胸を躍らせて研究に参加しています。これは、大きな躍進であると思います。」
将来には、免疫療法(厳密にはプレシジョン免疫療法)ががん治療の主力になるでしょう。」
3年間で27%の生存率が確認されています。これは肺がんでは前代未聞の生存率で、通常、2年間の生存率は11%、3年間の生存率はほぼゼロでした。
Ghandi博士は、次のように付け加えています。「すべての患者に対して改善したいということを忘れないことが重要です。私たちは、免疫応答を刺激する方法があることを知っています。そして、一部の機構が免疫応答を損なう可能性があることも知っています。理論的には、これらの問題を克服し、腫瘍の免疫原性を向上して、免疫系が腫瘍を認識できるようにすることが可能です。私たちは、この目標に向かって取り組んでいます。」
「転移性疾患に対して有効であれば、がんの発症早期にこれらの治療法を適用したいと考えています。(がんではない)肺内小瘤が、がんに進行しないよう、免疫療法で治療できるか調べる治験が計画されています。」
当然のことながら、数年以内にがんとの闘いに勝利を収め、過去50年間のような失敗を繰り返すことはないと、2人の博士が同意しています。引き続き、膨大な量の基礎研究や交流研究だけでなく、継続的なコラボレーションと従来からの革新が必要になります。
長い道のりとなることは確実ですが、今では追い風を受け、前途は以前にもまして明るいです。
詳細については、このウェビナーで、Ghandi博士による免疫療法における最近の進歩をご覧ください。

