Valita Titer アッセイを用いた迅速なウサギIgG定量
はじめに
1970年代に融合細胞作製技術が実現して以来、抗体生産の際のホスト生物として、主にネズミやマウスなどのげっ歯類が使われてきました。ですが、他生物種の免疫系に関する見識が深まるにつれ、げっ歯類にはない特性を持つ他の生物が、より好適な宿主と捉えられるようになってきています。その一例がウサギです。ウサギの免疫系は、げっ歯類の免疫系より広い範囲の抗原を認識することができると考えられています。加えて、ウサギによって産生された抗体は、げっ歯類抗体と比較すると、ヒト由来のエピトープや、マウスは免疫応答を引き起こさないことが知られているエピトープに対して極めて高い親和性を示します。抗体産生の宿主としてのウサギの短所は、免疫付与にかかる期間が長いことでプロジェクト期間がより長くなることや、げっ歯類よりも飼育が難しく、時間のかかることによるコストの増加が挙げられます。こうした短所をカバーするために、抗体の開発の全過程で、迅速、正確かつ経済効果の高いウサギ由来lgGの測定法が必須です。このアプリケーションノートでは、Valita Titerアッセイをハイスループットで迅速かつ正確にウサギ由来IgGを定量するツールとして使用できることを実証します。
Valita Titerアッセイ
Valita Titerアッセイは、蛍光偏光(FP)を検出に利用した、迅速でハイスループットなIgG定量法です。このアッセイは、IgGのFc領域に特異的に結合する蛍光標識されたプローブ(ペプチド) と、IgGのFc領域との相互作用を利用しています。溶液中では一般的に小さな分子は大きな分子よりも速く回転するため、蛍光偏光を測定すれば、分子サイズの変化を効率的に分析することができます。分子が光子を吸収、放出するまでに起こる分子の回転が、偏光に「ねじれ」を生じさせます。IgGが結合していない蛍光標識されたIgG結合ペプチドは、IgGと結合した抗体結合ペプチド(IgGと結合すると最大で20倍大きくなる)よりも速く回転するため、光の偏光性が失われます。つまり、蛍光偏光(FP)は、溶液に平面偏光を照射して励起し、平行平面に放出された励起光(偏光が維持されている割合)の強度と、垂直平面に放出された励起光の強度(偏光が失われた割合)を計測し、この2つの強度を正規化した差分として表わしたもので、通常、ミリ偏光単位(mP)で表示されます。
Figure 1 Valita Titerアッセイの測定原理。抗体に結合していない小さな分子は、溶液中で高速回転します
(上)が、抗体に結合した大きな分子は、ゆっくりと回転します(下)
材料と方法
- Valita Titerアッセイ、製品番号:VAL003、検出レンジ: 2.5 - 100 mg/L
- CD CHO培地 (GibcoTM、製品番号:10743)
- BMG Labtech PHERAstar Multimodeプレートリーダー
- モノクローナルウサギIgG アイソタイプコントロール抗体 (LSBio, 製品番号:LS-C742137)
- 正常ウサギIgGコントロール(ポリクローナル) (SinoBiological 製品番号:CR1)
- ThermoFisher フィンピペットF2 (製品番号:10413865, 1187735, 11887351, 4662060)
- Starlab TipOneチップ (0.5- 200 μL 製品番号:S1111-1700)
(1000 μL 製品番号:S1111-6811)
方法
BMG Labtech社製 Pherastarプレートリーダーの設定
| 光学設定 | 蛍光偏光、エンドポイント 光学モジュールFP 485 520 520 蛍光ウェルから焦点とゲインを最適化(0 mg/L) ゲインの目標mP:70mP |
| 一般設定 | 各ウェル200フラッシュ 設定時間0.5秒 |
ウサギモノクローナルIgG:
ウサギモノクローナルIgG標準液は、メーカーの指示に従い、蒸留水で濃度4 mg/mLに溶液調製しました。希釈はCD-CHO培地内で行い、100 mg/L~ 0 mg/L の範囲内8点を用いた検量線を作成しました。テストサンプルは、CD-CHO培地内で希釈した4 mg/mLストック溶液から調製しました。
ウサギポリクローナルIgG:
ウサギポリクローナルIgGはメーカーよりpH 7.4のPBSに1 mg/L濃度で溶解したものを入手しました。CD-CHO培地内で連続希釈を行い、100 mg/L~0 mg/L の範囲内8点を用いた検量線を作成しました。テストサンプルは、CD-CHO培地内で希釈した1 mg/mLストック溶液から調製しました。
アッセイ手順
- 細胞培養用培地60 μLを各ウェルに添加し、Fc領域に特異的に結合するプローブを溶解します(Valita Titerアッセイプレートの表面に、乾燥した状態でコートされています)。
- 96ウェルプレートの適切なウェルに、標準液/サンプル60 μLを添加します。
- マルチチャネルピペットを用いて各ウェルを3度攪拌した後、暗所で5分間インキュベーションします。
- インキュベーション終了後、プレートをFPモードで測定します。
| 1. Valita TiterプレートはIgGに 特異的に結合するペプチドが コーティングされています。 |
2. テストサンプル中のIgGは 結合したペプチドと複合体を 形成します。 |
3. IgG濃度はプレートリーダーの FPモードで計測します。 |
Figure 2 蛍光偏光をIgG定量に用いるValita Titerアッセイの概要
1. プレートの各ウェルにはあらかじめIgGのFc領域に特異的に結合するペプチドがコーティングされています。
2. IgGサンプルがプローブに結合します。
3. 結合は蛍光偏光モードで測定します。
結果
Valita Titerアッセイでウサギ由来のIgGを正確に検出・定量可能かを、モノクローナル抗体およびポリクローナル抗体の両方で評価しました。この評価法は相対定量化法であるため、より正確な結果を得るには、標準として使用する分子がテストサンプルと均質であることが重要です。この例では、モノクローナル抗体(mAb)のテストサンプルの定量には、mAb を用いて作成した検量線を使用しました。それぞれの抗体分子に対し、8点の検量線(0-100 mg/ L )を2度繰り返して作製し、Valita Titerで分析しました。検量線を作成すると同時に、既知濃度の試験サンプルを検量線を用いて算出し、その測定精度を評価しました。
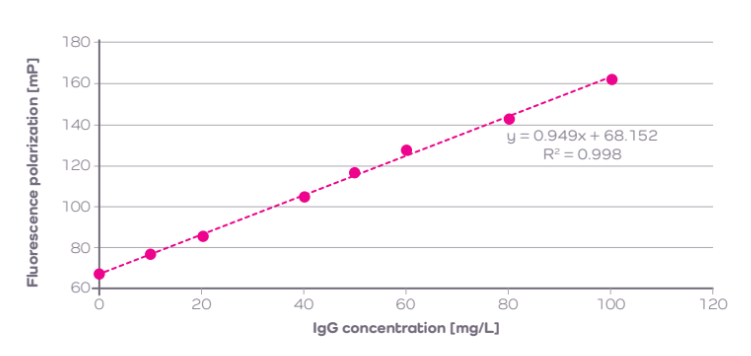
mAb の標準検量線サンプルには、IgG濃度[mg/L]を横軸、Raw FPを縦軸にプロットし、Figure 3 のような線形回帰が最適であると確認しました。線形方程式を用いて、得られたRaw FP値をyに代入してxを求め、 mAb テストサンプルの濃度を算出しました。
Figure 3 Cubic fit (3次多項式曲線)を用いてプロットしたウサギモノクローナルIgGのValita Titer検量線 (R2= 0.998)
このアッセイで、既知濃度のテストサンプルは、絶対濃度からの精度バイアスが8%以下、標準偏差2mp以下、プレート内変動係数2%以下と、正確に測定され、主要な受け入れ基準を全て満たしました[Table 1]。Figure 4から、Valita Titer アッセイによって生成されたアウトプットデータは、絶対値とR2 < 0.99という高い相関性があることが実証されています。
Table 1: Valita Titer を用いた濃度既知のmAbテストサンプルの定量で得られたデータのサマリ
| サンプル中IgGの既知濃度(mg/L) | 測定された濃度rep1 (mg/L) | 測定された濃度rep2 (mg/L) | 測定された濃度rep3 (mg/L) | 平均(mg/L) | 標準偏差(mP) | 精度バイアス(%) | 変動係数(%) |
| 90 | 93.5 | 92.3 | 90.3 | 92.0 | 1.55 | -2 | 0.999 |
| 60 | 64.3 | 63.8 | 61.1 | 63.0 | 1.63 | -5 | 1.275 |
| 55 | 58.0 | 58.1 | 56.1 | 57.4 | 1.05 | -4 | 0.856 |
| 40 | 39.7 | 39.0 | 38.8 | 38.8 | 0.92 | +3 | 0.874 |
| 25 | 25.9 | 25.1 | 24.8 | 25.3 | 0.55 | -1 | 0.596 |
| 12.5 | 13.3 | 13.6 | 13.4 | 13.5 | 0.14 | -8 | 0.173 |
| 10 | 10.7 | 10.6 | 9.6 | 8.8 | 0.58 | -3 | 0.745 |
Figure 4 Valita Titerアッセイで、ウサギモノクローナルIgGの抗体濃度の実測値と実濃度の比較 (R2 = 0.9973)
ポリクローナル抗体の検量線サンプルには、2次多項式フィッティングが最適の近似であることを確認しました。下記散布図で、IgG濃度[mg/L]は縦軸、Raw FPは横軸にプロットしました[Figure 5]。線形の方程式を使って、Raw蛍光偏光値アウトプットをxに代入してyを求め、ポリクローナル抗体テストサンプル濃度を算出しました。このアッセイで、既知濃度のテストサンプルの測定結果は絶対濃度からの精度バイアスが10%以下、標準偏差2 mp以下、プレート内変動係数2%以下となりました[Table 2]。Figure 6から、Valita Titerアッセイによって生成されたデータが、絶対値と0.99=R2という高い相関性があることがわかります。

Figure 5 2次多項式フィッティングを用いてプロットしたウサギモノクローナルIgGのValitaTiter検量線(R2 = 0.9941)
| サンプル中IgGの既知濃度(mg/L) | 測定された濃度rep1 (mg/L) | 測定された濃度rep2 (mg/L) | 測定された濃度rep3 (mg/L) | 平均(mg/L) | 標準偏差(mP) | 精度バイアス(%) | 変動係数(%) |
| 90 | 84.1 | 84.1 | 83.9 | 84.1 | 0.11 | +7 | 0.061 |
| 60 | 66.8 | 65.4 | 65.5 | 65.9 | 0.96 | -10 | 0.623 |
| 55 | 57.4 | 56.2 | 55.5 | 56.4 | 1.15 | -3 | 0.809 |
| 40 | 39.5 | 39.5 | 40.1 | 39.7 | 0.4 | +1 | 0.331 |
| 25 | 24.1 | 24.2 | 24 | 24.1 | 0.13 | +4 | 0.133 |
| 12.5 | 11.5 | 12.0 | 11.4 | 11.6 | 0.45 | +7 | 0.54 |
| 10 | 9.0 | 9.6 | 10.0 | 9.5 | 0.71 | +5 | 0.882 |
Table 2: Valita Titerアッセイによる検量線を用いたポリクローナルウサギIgGサンプル測定の精確性

Figure 6 Valita Titerアッセイで、ウサギポリクローナルIgGの抗体濃度の実測値と実濃度の比較(R2 = 0.9917)
結論
Valita Titerアッセイは、ウサギIgG標準液およびサンプルを、ロバストかつ正確に測定することが可能です。このアッセイはハイスループットで、開発の様々な段階でクルードなウサギIgGサンプルを直接、迅速かつ正確に定量することができます。
略語
FP: 蛍光偏光
mP: ミリ偏光単位
IgG: 免疫グロブリンG
著者
Dr. Anna Boland-ValitaCell Ltd.製品開発サイエンティスト。トリニティ・カレッジ・ダブリンにて分子薬学修了。クイーンズ大学ベルファストにて薬学のphDを取得。
Dr. Hannah Byrne-ValitaCell Ltd.バイオロジカルサイエンス部門長。ダブリンシティ大学にて分析科学修了、生物化学のphDを取得。