フローサイトメーターCytoFLEXを用いた、バイオレットレーザーの側方散乱光を利用してナノ粒子を検出する方法
George C. Brittain, Ph.D., Sergei Gulnik, Ph.D., Beckman Coulter Life Sciences, Miami, FL 33196
背景
フローサイトメトリーを用いたサブミクロンのナノ粒子検出は、粒子サイズが検出に使う光の波長よりも小さくなるにしたがって難しくなる。また、粒子によって生じる散乱光の量は粒子径に正比例し、検出に使う光の波長に反比例する。この関係性は、ミーの理論およびレイリー散乱の等式に見ることができる。これらの計算式はそれぞれ、粒子のサイズがそれを検出するのに使われる光の波長と同等あるいはずっと小さい場合において、粒子による光の散乱を理論的に求めるために使われている(Bohren & Huff mann, 2010)。ここで示したような関係性があるために、短波長の紫色光(405 nm)は任意の粒子サイズにおいて、青色光(488 nm)よりも直交方向の光散乱を多く生じ、標準的な側方散乱光による検出よりも、小さい粒子に対する解像度のレンジを増加させる。さらに、屈折率の異なる媒質に入射した光波は、新しい媒質に入る際にその波長に反比例して屈折する。つまり、短波長の光の方が長波長の光よりも大きく屈折する。この効果を初めて発見したのはアイザック・ニュートンである。彼は、プリズムを使って白色光を虹の各色に分割し、赤色光の屈折が一番小さく、紫色光が最もよく屈折することを発見した(図1)(Newton, 1704)。
紫色光に関するこの物理学的な性質を利用することで、粒子およびそれを取り巻いている媒質の間にある屈折率の違いを増幅しやすくなり、エクソソームやマイクロベシクル、シリカナノ粒子といった屈折率の低いナノ粒子の検出能を向上させることができる。本文の目的は、バイオレットレーザー側方散乱光(Violet Side Scatter, VSSC)を用いてナノ粒子を検出する際の、フローサイトメーターCytoFLEXの設定方法を示すことである。

図1. 細胞を通る光に生じるニュートンの光屈折を、波長ごとに簡単に図示した。
VSSCを検出するためのCytoFLEXの設定
CytoFLEXにおけるVSSC検出の設定は簡単である。CytoExpertにおいて、メニューバーからCytometer のタブを選択し、さらにDetector Confi gurationを選択するだけでよい。Detector Confi gurationのポップアップウィンドウの中で、450 nmのフィルタを405 nmのフィルタと入れ替え、その検出器にVSSCとして適切な名前をつける。検出器構成を保存した後、その構成が有効になるように選択することで、装置内において405 nmのフィルタを450 nmのスロットに移動させることができる。このとき、新たな検出器構成を適用するには、CytoExpertプログラム内で新しいエクスペリメントを開始する必要があるが、それが済めば解析を始めることができる。
測定を始めたら、VSSCを用いてバックグラウンドノイズからナノ粒子を適切に分離するために、Acquisition Setting Menuを開いてVSSCをPrimary Thresholdとして選択し(AreaよりもHeight の方が好ましい)、ノイズと実際のイベントの間の識別限界に達するまで、マニュアルでTrigger Levelを調節する。CytoFLEXでは、このTrigger Level が、使用するレーザー強度およびゲイン設定において非常に一貫しており、エクスペリメントや使用日が異なってもほとんど変化しない。
覚えておくべきことをいくつか述べると、VSSCヒストグラムのデフォルトの設定では小さな粒子の存在がy軸値を押し上げてしまうため、目的のサイズレンジをしっかりと表示させるには、VSSCヒストグラムのレンジを調節する必要がある。レンジを決めておくことで、多峰性の粒子サイズ分布を対数目盛りによってうまく表現することができる。また、カウント数の軸目盛りに関して“Fit with Sample”が選択されていると、ヒストグラム全体を表示させるよう目盛りが常に調節される。最後の問題に関しては、サイズの小さい解析対象粒子を用いて実験的にThreshold Trigger Levelを決めているのではなく、バッファを単独で使用した条件をもとに設定している場合には、特に混乱を生じうる。この場合、トリガーをどのように設定したかにかかわらず、ノイズのヒストグラムを最大値として再調節し続けてしまうことに加えて、レファレンスとして使用する粒子がない状態で実験を始めると、実際に選択したトリガー設定によって解析対象の粒子が切り捨て・排除される可能性がある。最もよいのは、入手可能な粒子のうち、検出できる範囲で最も小さく、かつバックグラウンドノイズと明瞭に区別できる粒子を使って、トリガーの設定を行うことである。このような粒子を使用することで、実際のサンプル粒子のポピュレーションに合わせた解析をすることができ、さらに残っているノイズが許容できるレベルになるまでトリガーを下げることが可能になる(図2)。しかし、設定した閾値レベルが低すぎる場合は、ノイズによってアボート率が上昇する。究極的には、閾値やサンプル濃度、フローレートを調節することで、5~10%未満のアボート率を維持できるよう努めるべきである。サンプル濃度およびフローレートを低く維持することは、実験上偶然生じるアーティファクト(スウォーミングなど)を防ぐという点においても重要である(Nolan, 2015; Nolan & Stoner, 2013)。

図2. VSSCの切り替え限界値を設定して、実際のサンプルポピュレーションとバックグラウンドノイズを分離した例。
サンプルは、0.02 μmのフィルタでろ過した水を用いて1:100K希釈した100nmポリスチレンビーズである。
サンプル調製において考慮すべき点
マイクロおよびナノ粒子の解析では、解析するサンプルの調製について注意すべき点がいくつかある。第1 に、サンプルを懸濁するバッファについては、解析対象のポピュレーションのレンジと重なる可能性のあるバックグラウンドデブリを除去するために、一定の分子量以下の物質を適切に除去できるようろ過すべきである。第2に、プロトコルやデータシートに通常記載されていることであるが、測定の直前には、泡が生じるほどサンプルを激しく混和しないようにすべきである。このときに生じた泡は光を屈折し、イベントとして検出されてしまうため、データ取得に干渉してしまうからである。第3に、サイズの小さい合成粒子の多くは、互いに凝集する傾向を持っており、凝集塊を形成することでサイズ測定が不正確になったり、すべてアボートされてしまったりする可能性がある。泡および凝集塊のいずれに対しても、測定前におけるサンプルのソニケーションが有効となる場合がある。ソニケーション後は、時間が経つにつれて凝集塊が再び生じてしまい、サンプルのポピュレーションにも影響するため、測定はできるだけ早く実施する(図3)。生体サンプルを扱っているなどでソニケーションができない場合は、測定前にサンプルをできる限り分散し、サンプルが均一に分布するようにすればよい。最後に、フローサイトメトリーの最適な測定レンジを決めるために、サンプルの濃度検討を行う必要がある。サンプル濃度が高い場合には、凝集やスウォーミングが生じる可能性があるからである(図4)。
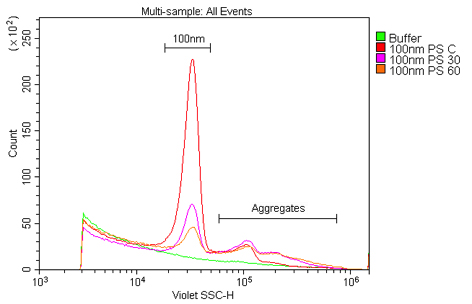
図3. ポリスチレンナノ粒子のポピュレーションが発するシグナルの経時的な減弱。
サンプルは、0.02 μmのフィルタでろ過した水を用いて1:100K希釈した100 nmポリスチレンビーズである。
ソニケーション後、0、30、および60分に測定を行った。
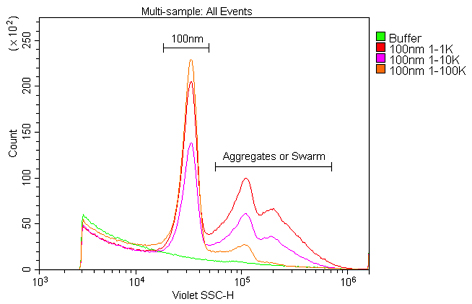
図4. ナノ粒子サンプルにおける最適な濃度の検討。
サンプルは、0.02 μmのフィルタでろ過した水を用いて、
1%のストックソリューションから1:1K、1:10K、および1:100K希釈した100 nmポリスチレンビーズである。
この結果から、検討した希釈倍率のうち、最もシグナルが良好で、かつ凝集やスウォーミングが少ないのは、1:100Kであることが明らかに見て取れる。
CytoFLEXにおけるVSSCによるナノ粒子検出能の検証
次に示した実験は、CytoFLEXでVSSCを使用した場合における200 nm未満のナノ粒子の検出能を明らかにすることを目的として行った。
装置および試薬
| 製品 | 製品番号 | 製造業者 |
| 3-Laser CytoFLEX | B53000 | Beckman Coulter |
| CytoFLEX Sheath Fluid | B51503 | Beckman Coulter |
| Whatman Anotop 25 0.02μm Filteres | 09-926-13 | Thermo Scientific |
| 40 nm Polystene Beads NIST | 09-980-015 | Thermo Scientific |
| 100 nm Polystene Beads NIST | 09-980-021 | Thermo Scientific |
| 200 nm Polystene Beads NIST | 09-980-024 | Thermo Scientific |
| Multimodal Particle Size Standards | MM-010 | Thermo Scientific |
| 94 nm Silica Beads NIST | 147020-10 | Corpuscular, Inc. |
| 150 nm Silica Beads NIST | 147030-10 | Corpuscular, Inc |
| 200 nm Silica Beads NIST | 147040-10 | Corpuscular, Inc |
結果
我々はまず、80 nm、200 nm、および500 nmのポリスチレンビーズが混合されているDuke Multimodal Particle Size Standardsを用いて、405 nm VSSCを使用した場合のナノ粒子の検出感度を、標準的な488 nm SSCの場合と比較した。図5Aからわかるように、VSSCは80 nmおよび200 nmのナノ粒子を容易に識別することができた。一方SSCは、200 nmおよび500 nmのポピュレーション間の差しか識別することができなかった。FSC、SSC、およびVSSCの検出結果をもとに、さまざまなポピュレーションにおけるシグナル-ノイズ比を測定したところ、VSSCは測定したすべての粒子サイズにおいてSSCよりも優れていた(図5B)。ヒストグラムを見ても、CytoFLEXでVSSCを使用した場合には、Duke Multimodal Particle Size Standardsに含まれる80 nmのナノ粒子ポピュレーションが容易に識別できたことがわかる(図6)。40 nmのポリスチレンナノ粒子についてもバックグラウンドと明瞭に識別できたが、そのデータ範囲はノイズの閾値上に位置していた(図7)。ポリスチレンビーズの屈折率は1.5915(589 nmにおける値)であるため、我々は平均屈折率がおよそ1.426であるエクソソームやミクロソームのレンジに近い、屈折率1.4584(589 nm)のシリカナノ粒子についても試験を行った(Gardiner et al., 2014)。その結果、150 nmおよび200 nmのシリカナノ粒子を容易に識別することができた。94 nmのシリカナノ粒子も検出することはできたが、データ範囲がノイズ閾値上にあった(図8)。


図5. 405 nm VSSCおよび488 nm SSCにおけるナノ粒子の検出感度の比較。
0.02 μmのフィルタでろ過した水を用いて1:10K希釈したDuke Multimodal Particle Size Standards(80 nm、200 nm、および500 nm)を、CytoFLEXで分析した。
VSSCとSSCのドットプロット(A)。FSC、SSC、またはVSSCを使用して測定した各サイズのナノ粒子に関するシグナル-ノイズ比のプロット(B)
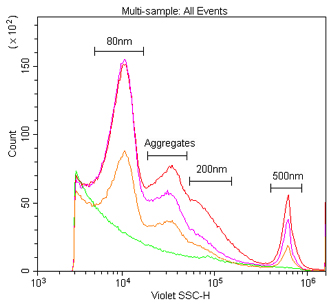

図6. VSSCおよびSSCによる80 nm、200 nm、および500 nmのポリスチレンナノ粒子の検出および識別。
0.02 μmのフィルタでろ過した水を用いて、Duke Multimodal Particle Size Standards(80 nm、200 nm、および
500 nm)の1%のストックソリューションを1:1K、1:10K、または1:100Kで希釈し、405 nm VSSC(A)および488 nm SSC(B)で検出した。
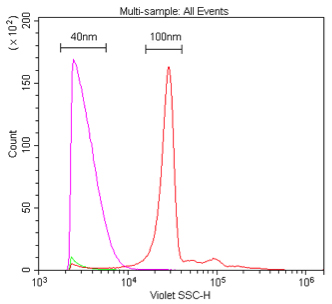
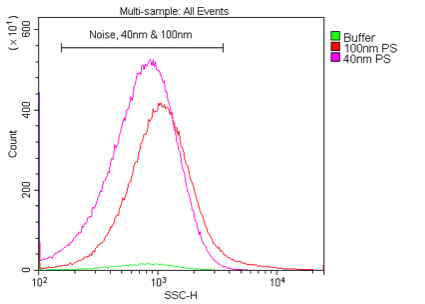
図7. 405 nmおよび488 nmにおける40 nmポリスチレンナノ粒子の散乱光検出の比較。
0.02 μmのフィルタでろ過した水を用いて、40 nmまたは100 nmのポリスチレンビーズをそれぞれ1:10K、
または1:100Kで希釈し(1%ストック)、405 nm VSSC(A)または488 nm SSC(B)で検出した。
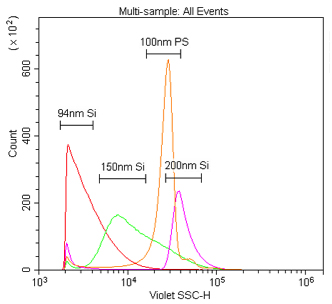
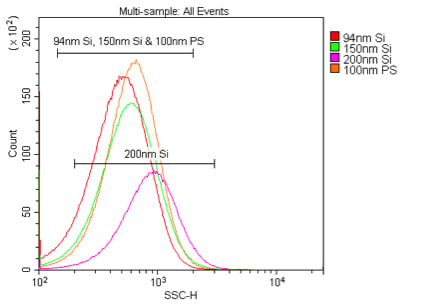
図8. 405 nmおよび488 nmにおけるシリカナノ粒子の散乱光検出の比較。
0.02 μmのフィルタでろ過したPBS中の94 nm、150 nm、または200 nmシリカ、もしくは100 nmポリスチレンナノ粒子をサンプルとした。
1%のストックソリューションから、シリカナノ粒子は1:10K、ポリスチレンナノ粒子は1:100Kの倍率で希釈し、
405 nm VSSC(A)または488 nm SSC(B)で検出した。
結論
CytoFLEXにおいてVSSCを用いた場合には、80 nmのポリスチレンおよび150 nmのシリカナノ粒子をバックグラウンドノイズから明瞭に識別することができた。また、VSSCのナノ粒子検出および識別能は、試験したすべての粒子サイズにおいて、SSCよりも優れていた。これらの知見から我々は、VSSCを使用すれば150 nmまでのサイズの細胞外小胞の検出にCytoFLEXを利用できると、自信を持って言うことができる。過去の研究では、屈折率が1.6に近い(ポリスチレンに類似した)50 nmというより小さな小胞において、細胞外小胞の屈折率が小胞の大きさに反比例することが示されているため(Gardiner et al., 2014)、さらに小さい小胞をVSSCで検出できる可能性もあるが、これについては実験的に明らかにしていく必要がある。
References
1. Arraud, N., Gounou, C., Turpin, D., Brisson, A.R (2015). Fluorescent triggering: a general strategy for enumeration and phenotyping extracellular vesicles in flow cytometry. Cytometry Part A, doi: 10.1002/cyto.a.22669. [Epub ahead of print]
2. Bohren, C.F. & Huffmann, D.R. (2010). Absorption and scattering of light by small particles. New York: WileyInterscience.
3. Gardiner, C., Shaw, M., Hole, P., Smith, J., Tannetta, D., Redman, C.W., and Sargent, I.L. (2014). Measurement of refractive index by nanoparticle tracking analysis reveals heterogeneity in extracellular vesicles. Journal of Extracellular Vesicles, 3: 25361-25366.
4. Hielscher, A.H., Mourant, J.R., and Bigio, I.J. (1997). Influence of particle size and concentration on the diffuse backscattering of polarized light from tissue phantoms and biological cell suspensions. Applied Optics, 36(1): 125-135.
5. Newton, I. (1704). Opticks: or, a treatise of the reflexions, refractions, inflexions and colours of light. Also two treatises of the species and magnitude of curvilinear figures. London: Samuel Smith & Benjamin Walford (Printers to the Royal Society).
6. Nolan J.P. (2015) Curr Protoc Cytom. 73: 13.14.1-13.14.16.
7. Nolan, J.P, & Stoner, S.A. (2013). A trigger channel threshold artifact in nanoparticle analysis. Cytometry Part A, 83(3): 301-305.
8. Poncelet, P., Robert, S., Bouriche, T., Bez, J., Lacroix, R., Dignat-George, F. Cytometry Part A doi: 10.1002/ cyto.a.22685. [Epub ahead of print]

