沈殿および遠心分離を組み合わせたキットを使用しない効率的な核酸分離法
Content Type: Application Note
Julia P Luciano-Chadee, Beckman Coulter, Inc., Indianapolis, IN 46268
Overview
免疫療法や遺伝子治療では、遺伝子編集情報を持ったプラスミドを宿主細胞に届けるために、純度の高いDNAが必要となる。DNAを高品質かつ高収量で得るため、キットを使わないプラスミドミニプレップが従来から用いられてきた。この手法は、塩とイソプロパノールを組み合わせて使用し、遠心によって溶液中の核酸を効率的に沈殿させるものである。ハイスループットかつコスト効率が良く、メンブレンやフィルターとの相互作用による損失がないため、高い収率でDNAを得ることができる。
Introduction
免疫療法とは、疾患と闘うための免疫システムをリプログラミングする治療法である。この治療で必要となるものは、遺伝物質そのもの、あるいはウイルスベクターのような生物学的製剤を用いた治療によって、細胞をリプログラミングすることである。
まずはじめに必要な材料は、ほとんどの場合、リプログラミングに必要なDNA断片を含んだプラスミドであり、まずはこの生産と単離を行う。プラスミドDNAの単離は、免疫療法における遺伝子導入のために高品質な材料を生産する上で重要なステップである。免疫療法のほか、多くの分子生物学的手法においても、高純度かつ濃縮されたプラスミドDNAが必要となる。
アデノウイルスは、免疫療法における遺伝子のデリバリーシステムの最もよく使用されている。アデノウイルスを用いた免疫療法についてはこれまでに、安全性を向上し、効率を高めるための評価・最適化がなされてきた。この治療法の開発は、宿主細菌細胞から組換えバキュロウイルス発現ベクター(バクミド)を作製するところから始まる。
本稿では、以前から行われてきた塩およびイソプロパノールを併用するプラスミド(バクミド)単離法のほか、遠心によって溶液から核酸を効率的に分離する手法について述べる(図1)。
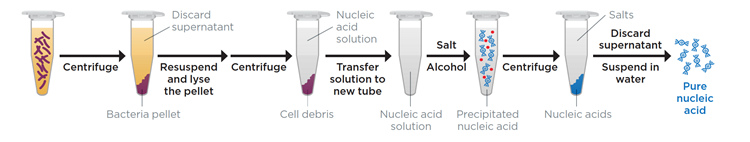 |
| 図1.核酸のイソプロパノール沈殿の概略図 |
What You Would Need
- Max Efficiency DH10Bac細菌細胞株(カタログ番号10361-012)、pFastBac-gus(カタログ番号91401)、NanoDrop 8000分光光度計およびversion 2.3.2の測定用ソフトウエアはThermo Scientificより購入した。
- Microfuge 20R(製品番号B30147)のIVDモデルおよびこれに搭載するFA241.5Pロータは、ベックマン・コールターが提供した。
What You Would Do
ヒートショックによる形質転換
あらかじめ冷却しておいた15 mLの丸底チューブに、菌液100 μLを分注した。この菌液を入れたチューブにpFastBacプラスミド1 ngを添加し、細胞とプラスミドを混合して氷上で30分間インキュベートした。次に、このチューブを42℃で45秒間処理した後、直ちに氷水浴に移して2分間静置した。チューブに500 μLのSOC培地を添加し、細菌を220 rpm、37℃で4時間振盪培養した。カナマイシン(kan)、ゲンタマイシン(gen)、テトラサイクリン(tet)、およびIPTGを含む条件LB寒天プレート上に細菌を播種し、選択培養を行った。48時間後に陽性コロニーを観察した。
細胞増殖および回収
陽性コロニーの1つを採取してkan/gen/tet/IPTGを添加した5 mLのLB培地に再懸濁し、220 rpmで振盪しながら37℃で増殖させた。16時間後、FA241.5Pロータを搭載したMicrofuge 20Rを使用して、細胞をRCF 10,000 × gで2分間遠心した。上清を捨て、ペレットを次のステップに使用した。
プラスミド単離
プラスミド単離は、次の5つのステップからなる:すなわち、細菌の溶解、残渣の除去、核酸の沈殿、核酸の単離、および再懸濁である。溶液はあらかじめすべて調製しておき、それぞれの作業に対応する温度で保管した。すべての遠心ステップにおいて、FA241.5Pロータを搭載したMicrofuge 20Rを使用した。
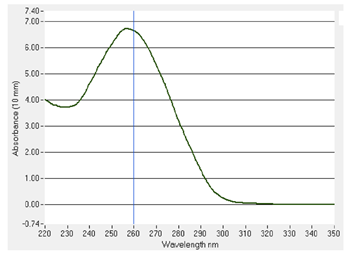 |
| 図2.プラスミド(バクミド)の核酸スペクトル |
- 細菌の溶解。まず、細菌を500 μLの緩衝液(25 mM Tris-HCl[pH 8]、50 mMグルコース、10 mM EDTA、 RNAse A 1%添加)中に入れた。チューブを5回転倒混和後、0.2 N NaClおよび1%(w/v)SDSを含むアルカリ溶解バッファを500 μL添加した。NaOHは、細胞壁を破壊するために重要であるが、最大の目的はDNAを変性させることにあり、これが分離において重要なステップとなっている。SDSには、細菌に含まれるタンパク質を変性させる役割がある。チューブを5回転倒混和し、室温で5分間インキュベートした。5Mの酢酸カリウム溶液500 μLを添加し、プラスミドDNAを再生・安定化させた。これは、宿主細胞のゲノムDNAから小さなプラスミドDNAだけを分離するためのステップである。混合後、氷上で10分間インキュベートした。
- 残渣の除去。宿主DNA、タンパク質、細胞残渣といった汚染物質から目的のプラスミドを分離するため、室温においてサンプルを15,000 x gで10分間遠心し、核酸溶液を新しいチューブに移した。
- 核酸の沈殿。溶液から核酸を取り出すため、イソプロパノール800 μLを添加し、チューブを氷上で10分間インキュベートした。このステップによって、ペレット中にDNAが沈殿することになる。
- 核酸の単離。遠心分離によって、目的のプラスミドDNAを不純物から分離する必要がある。室温においてサンプルをRCF 15,000 x gで15分間遠心した。DNAペレットを氷冷エタノール500 μLで洗浄し、10分間風乾させた。
- 再懸濁。乾燥したDNAペレットを70 μLのTEバッファまたは水に再懸濁し、濃度(および質)を分析した。
What You Would Expect
NanoDrop 8000分光光度計を測定用ソフトウエアに接続し、2 μLのサンプルを計測した。5 mLの菌液から、332.1 ng/μL†の濃度でDNAが得られた。典型的な核酸のスペクトル(図2)が認められ、260/280比が2.1、260/230比が1.8となった。
Conclusion
以前から使用されてきたプラスミド単離法は、効率的かつ経済的である。沈殿形成をベースとしたDNA単離法は、ラボにある標準的な試薬を使ってバッファを調製できることに加え、遠心機さえあれば実施可能である。今回の実験結果(図2)から、メンブレンやフィルターを使用しないこのDNA精製法が、高品質の組換えアデノウイルスのウイルス粒子を生産するのに十分なプラスミド濃度を供給できるワークフローであることが分かる。また必要であれば、初期培養の条件を最適化することで、プラスミド量を500 μgまでスケールアップできる。この際に市販のキットを購入して多大な追加コストを支払う必要はない。さらに、他の遠心分離技術を導入することで、ラージスケールでDNAを単離するためのソリューションを提供することもできる。CsCl勾配中でDNAを超遠心分離すれば、免疫療法やその他あらゆる下流アプリケーションのために高純度のDNAを大量に得ることも可能である。
References
Moore, D. and Dowhan, D. 2002. Purification and Concentration of DNA from Aqueous Solutions. Current Protocols in Molecular Biology. 59:I:2.1A:2.1.1–2.1.10.
Maniatis, T, E F Fritsch, and J Sambrook. Molecular Cloning. A Laboratory Manual. New York: Cold Spring Harbor Laboratory, 1982
Smith, A D, ed. Oxford Dictionary of Biochemistry and Molecular Biology. 2nd Edition. Oxford: Oxford University Press, 2000.
†このセクションで挙げたソフトウエアによって得られた結果を保証するものではない。個別の免責事項については、それぞれのソフトウェアツールを参照のこと。
CENT-4959PST02.19

